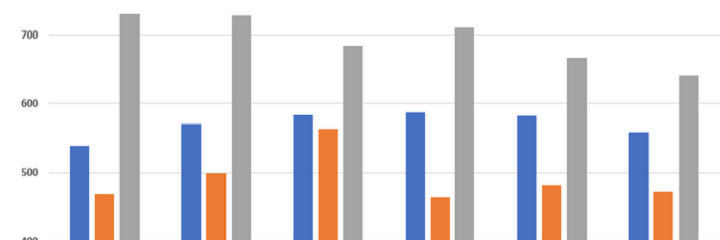
Update: Openbaarmaking resultaten klinische proeven met geneesmiddelen via EU Clinical Trials Register
Ik heb al twee keer eerder een overzichtje geproduceerd van de stand van zaken rond het publiceren van de onderzoeksresultaten van klinische proeven met...