Het is niet eenvoudig gebleken om een template of model onderzoeksprotocol te vinden dat ook geschikt is voor internationaal geneesmiddelonderzoek. Bij het samenstellen van een template protocol ontstond ook de behoefte aan verschillende flowcharts om de routing en wijze van ‘Safety Reporting’ inzichtelijk te maken.
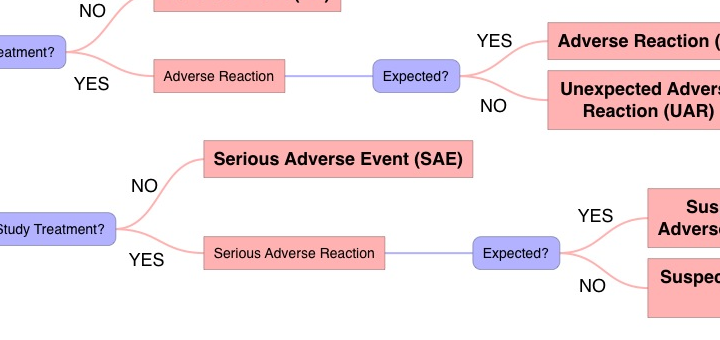
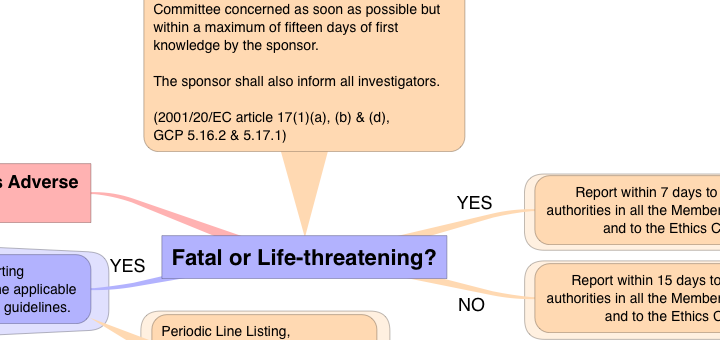
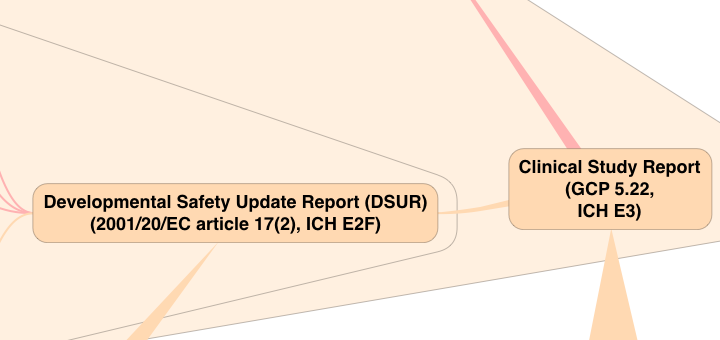
Met behulp van de flowchart ‘AE, SAE, SSAR, SUSAR’ kan worden nagegaan tot welke categorie een adverse event behoort en tevens wat de verantwoordelijkheden en taken van de verrichter en de onderzoeker zijn.