Verordening (EU) 2017/745 betreffende medische hulpmiddelen en Verordening (EU) 2017/746 betreffende medische hulpmiddelen voor in-vitrodiagnostiek
Op 5 mei 2017 zijn de EU verordeningen betreffende medische hulpmiddelen en medische hulpmiddelen voor in-vitrodiagnostiek gepubliceerd in het Publicatieblad van de Europese Unie (PB L117, 5 mei 2017).
De verordening betreffende medische hulpmiddelen “treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie” (oftewel 25 mei 2017) en “is van toepassing met ingang van 26 mei 2020” (bron: Verordening (EU) 2017/745, artikel 123(1) en 123(2)).
De verordening betreffende medische hulpmiddelen voor in-vitrodiagnostiek “treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie” (oftewel 25 mei 2017) en “is van toepassing met ingang van 26 mei 2022” (bron: Verordening (EU) 2017/746, artikel 113(1) en 113(2)).
Hoe gaat Nederland de verordeningen implementeren?
Zoals aangegeven in de Nieuwsbrief voor Goede Onderzoekspraktijken nr. 28 van 8 april 2017 is er nog weinig bekend over hoe een en ander ingevuld gaat worden voor wat betreft klinisch onderzoek.
Samen met het ministerie van Volksgezondheid, Welzijn en Sport, de Inspectie voor de Gezondheidszorg en het Rijksinstituut voor Volksgezondheid en Milieu werkt de Centrale Commissie Mensgebonden Onderzoek (CCMO) aan een implementatieplan (bron: CCMO, z.d.). De verwachting is dat de CCMO een belangrijke coördinerende rol gaat spelen bij het aanmelden en beoordelen van klinisch onderzoek met medische hulpmiddelen (bron: IGZ, verslag invitational conference; CCMO themapagina, z.d.).
 |
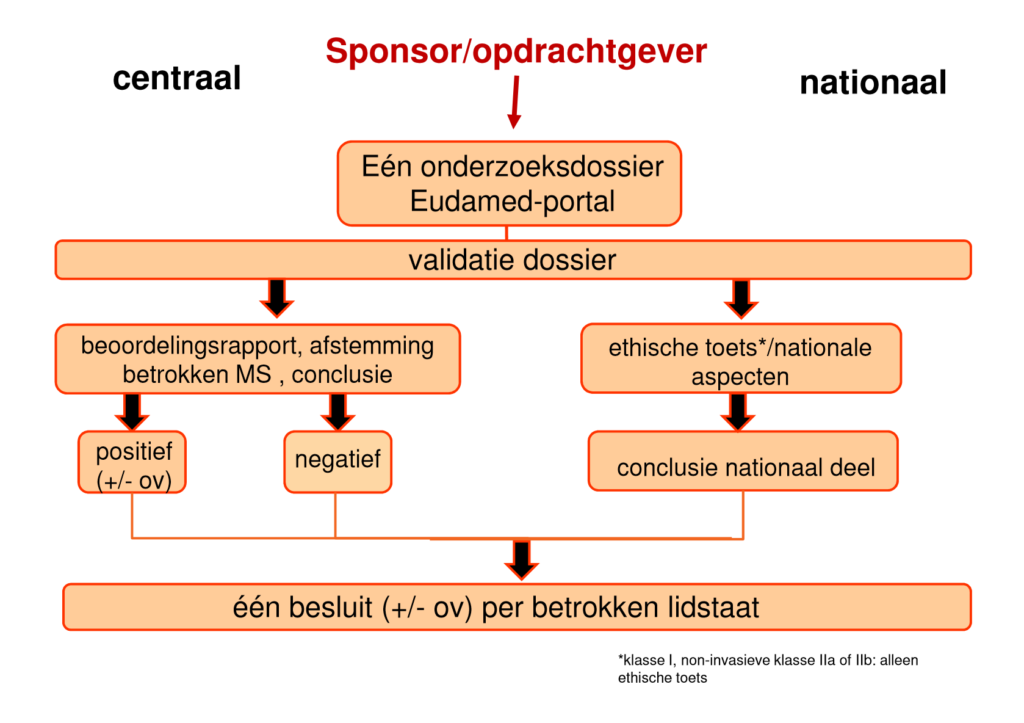 |
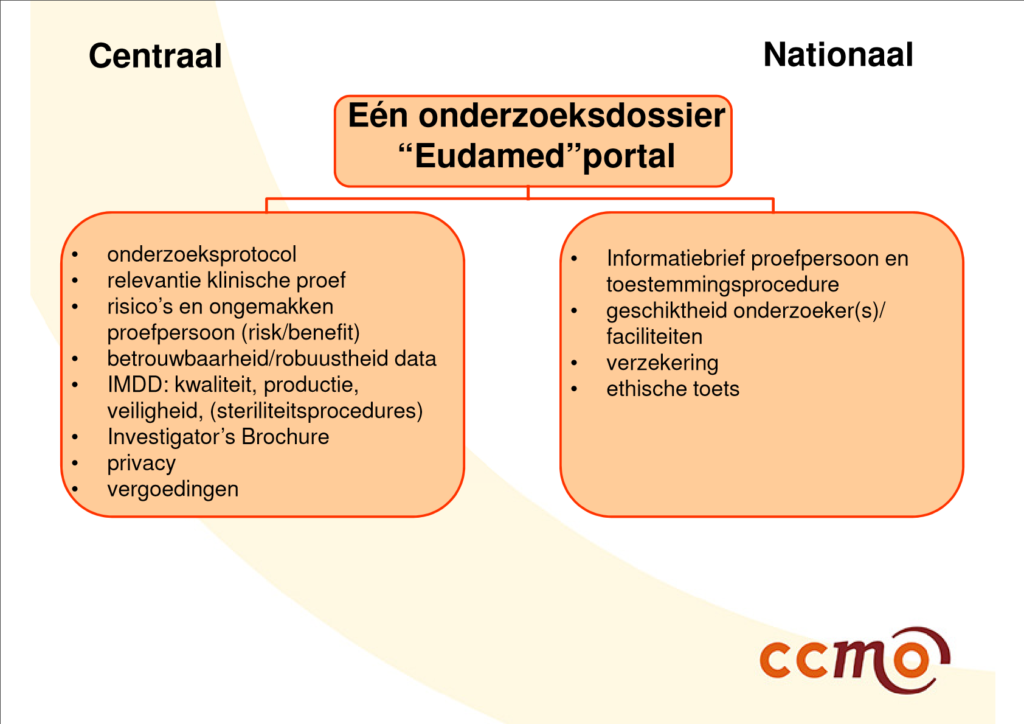
| Slide 21 en 22 uit presentatie van Al, M. (15 december 2016). Klinisch onderzoek met medische hulpmiddelen: de rol van de METC. Centrale Commissie Mensgebonden Onderzoek, gegeven op Invitational conference ‘Klinisch onderzoek met medische hulpmiddelen’ van 15 december 2016, georganiseerd door IGZ. | |
De tijd zal het leren of het uiteindelijke proces van valideren en beoordelen van klinisch onderzoek met medische hulpmiddelen onder de nieuwe verordeningen overeenkomt met het proces zoals werd geschetst ten tijde van de invitational conference van 15 december 2016 (zie bovenstaande afbeeldingen).
Eén ding zal voor iedereen duidelijk zijn, net als bij de implementatie van de verordening voor klinische proeven met geneesmiddelen zullen ook deze verordeningen de nodige inspanningen vragen van alle betrokken partijen om tot een succesvolle implementatie te komen.
Download de verordeningen
Middels onderstaande links kunnen de verordeningen betreffende medische hulpmiddelen en medische hulpmiddelen voor in-vitrodiagnostiek worden gedownload.
Tevens kunnen ook alleen de delen van de verordeningen die betrekking hebben op klinisch onderzoek, prestatiestudies en interventionele klinischeprestatiestudies worden gedownload.
- Verordening (EU) 2017/745 van het Europees Parlement en de Raad van 5 april 2017 betreffende medische hulpmiddelen, tot wijziging van Richtlijn 2001/83/EG, Verordening (EG) nr. 178/2002 en Verordening (EG) nr. 1223/2009, en tot intrekking van Richtlijnen 90/385/EEG en 93/42/EEG van de Raad
- Verordening (EU) 2017/746 van het Europees Parlement en de Raad van 5 april 2017 betreffende medische hulpmiddelen voor in-vitrodiagnostiek en tot intrekking van Richtlijn 98/79/EG en Besluit 2010/227/EU van de Commissie
De informatie uit dit bericht is overgenomen uit de Nieuwsbrief voor Goede Onderzoekspraktijken nr. 31 van 8 mei 2017 en de Nieuwsbrief voor Goede Onderzoekspraktijken nr. 32 van 14 mei 2017.