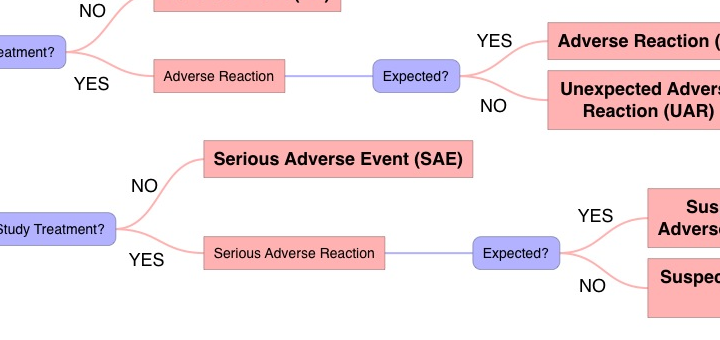
Flowchart: Wet medisch-wetenschappelijk onderzoek met mensen en de meldingsplicht voor ernstige ongewenste voorvallen
Sinds 1 oktober 2015 is de meldingsplicht voor ernstige ongewenste voorvallen van kracht. Om de wettelijke mogelijkheden voor het melden van SAE’s inzichtelijk te...