Uitgelicht en gespot op internet (week 50, 2021)
Ook deze week weer een nieuwe overzicht van actualiteiten en nieuwsberichten die de afgelopen week zijn gespot op het internet.
Voor de mensen die een nieuwe agenda onder de kerstboom zullen aantreffen, er zijn ook weer nieuwe bijeenkomsten en consultaties toegevoegd aan de ‘Events‘ pagina en de ‘Consultations‘-pagina. Ontbreekt er een belangrijk event? Neem dan contact met mij op via het contact formulier.
Algemene verordening gegevensbescherming (AVG), Adequaatheidsbesluit Republiek Korea
- Joint Press Statement by Didier Reynders, Commissioner for Justice of the European Commission, and Yoon Jong In, Chairperson of the Personal Information Protection Commission of the Republic of Korea (17-12-2021).
- Decision on the adequate protection of personal data by the Republic of Korea with annexes (17-12-2021). Europese Commissie.
- Questions & Answers on the adoption of the adequacy decision ensuring safe data flows between the EU and the Republic of Korea (17-12-2021). Europese Commissie.
- Over ‘eigen’ gegevens in de zorg (13-12-2021). MLCF.
All European Academies (ALLEA)
- Final Conference: ‘Health Inequalities: New Methods, Better Insights?’ (15-12-2021).
- A Patent Waiver Is Not a Silver Bullet in the Pursuit of Vaccine Equity (14-12-2021).
Biobanken
- Biobanking and risk assessment: a comprehensive typology of risks for an adaptive risk governance (13-12-2021). Life Sciences, Society and Policy.
- Human body donation: How informed are the donors? (25-08-2021). Clinical Anatomy.
Cel- en gentherapie
- KWF lanceert uniek Nederlands platform voor cel- en gentherapie.
- Ruim 5 miljoen voor cel- en gentherapie (16-12-2021). UMC Utrecht.
Clinical trials
Clinical Trials Regulation (CTR), Ernstige inbreuken (art. 52),
Clinical Trials Information System (CTIS)
- Clinical Trials Information System (CTIS): online modular training programme
- Guide to CTIS training material catalogue (updated 14-12-2021)
- Getting started with CTIS: Sponsor quick guide (13-12-2021).
- Newsletter: Clinical Trials Information System (CTIS) highlights – December 2021 (3-12-2021).
- Module 03
- Module 05
- Quick guide: How to manage a CT – CTIS Training Programme – Module 05 (16-12-2021).
- Step-by-step guide: How to manage a CT – CTIS Training Programme – Module 05 (16-12-2021).
- FAQs: How to manage a CT – CTIS Training Programme – Module 05 (updated 16-12-2021).
- Instructor’s guide: How to manage a CT – CTIS Training Programme – Module 05 (updated 16-12-2021).
- Module 10
- Instructor’s guide: How to create, submit and withdraw a Clinical Trial Application – CTIS Training Programme – Module 10 (updated 17-12-2021).
- FAQs: How to create, submit and withdraw a Clinical Trial Application – CTIS Training Programme – Module 10 (updated 17-12-2021).
- Checklist of required fields per application type – CTIS Training Programme – Module 10 (updated 17-12-2021).
- Step-by-step guide : Create, submit and withdraw a clinical trial application and nonsubstantial modifications – CTIS Training Programme – Module 10 (14-12-2021).
- Module 11
- FAQs: How to respond to Requests for Information received during the evaluation of a Clinical Trial Application – CTIS Training Programme – Module 11 (updated 16-12-2021).
- Instructor’s guide: How to respond to Requests for Information received during the evaluation of a Clinical Trial Application – CTIS Training Programme – Module 11 (updated 16-12-2021).
- Step-by-step guide: How to respond to requests for information received during the evaluation of a Clinical Trial Application – CTIS Training Programme – Module 11 (14-12-2021).
- Module 21
- Module 22
- Templates/forms
- Clinical Trial Information System (CTIS) structured data form – Multi trial substantial modification (updated 16-12-2021).
- Clinical Trial Information System (CTIS) structured data form – Notifications (updated 16-12-2021).
- Clinical Trial Information System (CTIS) structured data form – Annual Safety Report (ASR) (16-12-2021).
- Clinical Trial Information System (CTIS) structured data form – Request for information (RFI) (16-12-2021).
- Clinical Trial Information System (CTIS) list values (16-12-2021).
- Clinical Trial Information System (CTIS) structured data form – Initial application, additional Member State Concerned, substantial modification, non-substantial modification (updated 16-12-2021).
Data management
- Application Profile for Machine-Actionable Data Management Plans (16-12-2021). Digital Life Sciences.
- Application Profile for Machine-Actionable Data Management Plans (26-10-2021). Data Science Journal.
Dierexperimenteel onderzoek
- Norecopa Newsletter no. 7-2021 (17-12-2021).
- Systematic reviews van preklinische studies vergroten de transparantie en kwaliteit van proefdieronderzoek (16-12-2021). ZonMw.
Dutch Clinical Research Foundation (DCRF)
- 2021: Mijlpalen werkgroepen DCRF (15-12-2021).
- Multi-stakeholder workshop over de implementatie van “Good Lay Summary Practice” (14-12-2021).
European Medicines Agency (EMA)
- EMA Management Board: highlights of December 2021 meeting (17-12-2021).
- Guideline Clinical investigation of human normal immunoglobulin for intravenous administration (IVIg) (updated 16-12-2021).
- EMA launches the Regulatory Science Research Needs initiative (15-12-2021).
- International regulators’ reflections on remote approaches to GCP and GMP regulatory oversight during COVID-19 pandemic (13-12-2021),
Embryowet
De fracties van D66 en VVD zullen twee initiatiefvoorstellen voorbereiden. Dit betreft ten eerste een initiatief over pre-implantatie genetische diagnostiek bij dragers van ernstige erfelijke afwijkingen die zich in volgende generaties kunnen voordoen. Daarnaast worden de eerste stappen gezet tot aan wetsbehandeling met een initiatiefwet die het verbod op het doen ontstaan van embryo’s voor andere doeleinden dan het laten ontstaan van een zwangerschap, onder voorwaarden en na goedkeuring van het onderzoek door de CCMO (Centrale Commissie Mensgebonden Onderzoek), opheft. Met het oog op beide wetsvoorstellen starten initiatiefnemers een uitgebreide adviesronde en zullen zij de uitkomsten hiervan betrekken bij het maken van de wetgeving.
Ethical Framework Informing Breastfeeding Research and Interventions (EFBRI)
Global Alliance for Genomics & Health (GA4GH)
Good Clinical Practice (GCP), Good Manufacturing Practice (GMP), Remote inspections
Integraal Kankercentrum Nederland (IKNL)
Kwaliteit van onderzoek (grappig, maar ook met boodschap)
Medische hulpmiddelen
Medicines and Healthcare products Regulatory Agency (MHRA)
- MHRA’s new guidance on using real-world data to support clinical trials could get medicines to patients sooner (16-12-2021).
- MHRA Guidance on the use of real-world data in clinical studies to support regulatory decisions (16-12-2021).
Ministerie van Onderwijs, Cultuur en Wetenschap (OCW), Ministerie van Volksgezondheid, Welzijn en Sport (VWS), Ministerie van Binnenlandse Zaken en Koninkrijksrelaties (BZK)
- Ruim 100 zorgorganisaties aan de slag met elektronische gegevensuitwisseling (17-12-2021).
- Beleidsregel van de Minister van Volksgezondheid, Welzijn en Sport en de Staatssecretaris van Volksgezondheid, Welzijn en Sport van 1 december 2021, kenmerk 3282478-1019889-WJZ, houdende de wijziging van de Beleidsregels bestuurlijke boete Ministerie Volksgezondheid Welzijn en Sport 2019 (9-12-2021). Staatscourant.
- Nieuwe Archiefwet ingediend bij Tweede Kamer (19-11-2021).
- Eerste Kamer stemt in met Wet open overheid (Woo) (5-10-2021).
Nationaal Comité advies dierproevenbeleid (NCad)
Programma Zorgevaluatie en Gepast Gebruik (ZE&GG)
- De Inclusiemonitor: dé tool om inclusies te stimuleren en zorgevaluaties sneller af te ronden.
- Welkom bij de Inclusiemonitor.
Research integrity
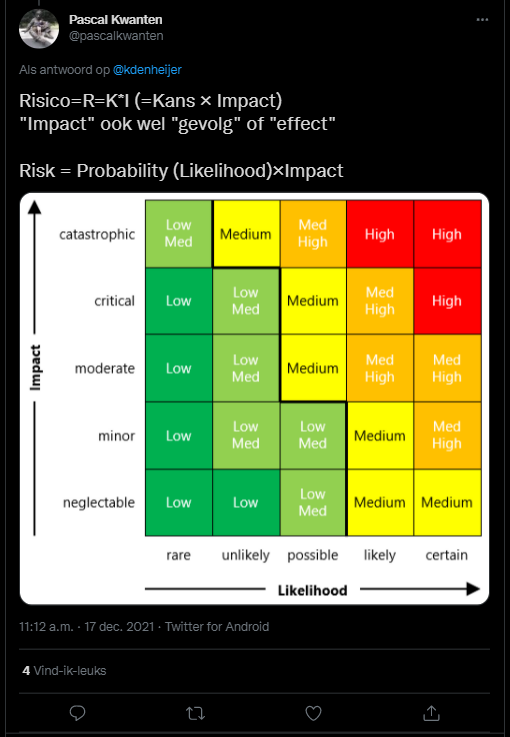
Risico, Veiligheidskunde
US Food and Drug Administration (FDA)
- FDA issues final guidance on pediatric anti-infective development (13-12-2021). Regulatory Focus.
- FDA Publishes Updated Clinical Outcome Assessment Compendium (13-12-2021). WCG CenterWatch.
- FDA Offers Advice for Sponsors of Individualized Gene Therapies (13-12-2021). WCG CenterWatch.
- FDA Issues More Guidance on Real-World Evidence, Delving into Noninterventional Studies (13-12-2021). WCG CenterWatch.
- Feasibility of Using Real-world Data to Emulate Postapproval Confirmatory Clinical Trials of Therapeutic Agents Granted US Food and Drug Administration Accelerated Approval. JAMA Netw Open. 2021 Nov 1;4(11):e2133667.
Overige
- Weekend reads: ‘Fraudulent and faulty research;’ a $275K settlement — but resignation — for a professor; ‘COVID-19, ivermectin, and beyond’ (18-12-2021). Retraction Watch.
- Resultaten 25 zorgevaluaties versneld opgenomen in richtlijnen (17-12-2021). ZonMw.
- How Valuable is Patient Direct Reporting in Pharmacovigilance? (2021). DIA Global Forum.
- Achieving end-to-end success in the clinic: Pfizer’s learnings on R&D productivity (15-12-2021). Drug Discovery Today.
- Cancer Trials Have a ‘Need for Speed’ — Decentralization Could Help (13-12-2021). WCG CenterWatch.
- Collaboration key to clinical trial sector growth post pandemic, ACRO (10-12-2021). Clinical Insider.
- Results on patient-reported outcomes are underreported in summaries of product characteristics for new drugs (7-12-2021). Journal of Patient-Reported Outcomes.
- Racial and Ethnic Representation in US Clinical Trials of New Drugs and Biologics, 2015-2019 (7-12-2021). JAMA.
- Access to COVID-19 Vaccines in High-, Middle-, and Low-Income Countries Hosting Clinical Trials. JAMA Netw Open. 2021 Nov 1;4(11):e2134233.
- The Landscape of COVID-19 Research in the United States: a Cross-sectional Study of Randomized Trials Registered on ClinicalTrials.Gov (9-11-2021). Journal of General Internal Medicine.
- Return of individual research results from genomic research: A systematic review of stakeholder perspectives (8-11-2021). PLoS ONE 16(11): e0258646.
- Pinkhof Geneeskundig woordenboek
Op de hoogte blijven van actueel nieuws, bijeenkomsten en publieke consultaties