|
||||
Beste lezer,
Hierbij ontvangt u de Nieuwsbrief voor Goede Onderzoekspraktijken van 18 juni 2017, met de laatste ontwikkelingen rond medisch-wetenschappelijk onderzoek met mensen, nieuwe wet- en regelgeving en gereviseerde richtlijnen.
Voor vragen, verzoeken en event/nieuwstips kunt u mij bereiken via e-mail info[at]bontrop.com en via het contactformulier op de website.
Met vriendelijke groet,
Inhoudsopgave
- Impressie ACRON symposium 'Lokale Uitvoerbaarheid' van 9 juni jl.
- Nieuwe ICMJE vereisten omtrent delen van onderzoeksdata: 'data sharing statement' en 'data sharing plan'
- Vanaf 19 juni gefaseerde vernieuwing ClinicalTrials.gov
- Voorbereiding AMvB openbaarmakingsbeleid inspectiegegevens vraagt meer tijd
- Presentaties van de NVFG ClinOpsDag 2017 zijn beschikbaar
- Breng uw nieuws, artikel of activiteit onder de aandacht van de lezers van de nieuwsbrief
- Inwerking treden Verordening (EU) nr. 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik uitgesteld naar 2019
- Gereviseerde ICH-GCP richtlijn per 14 juni 2017 van toepassing binnen de Europese Unie
- In het licht van de consultatie Wet zeggenschap lichaamsmateriaal
- Bijeenkomsten
- Publieke consultaties
- Uitgelicht
Medisch Wetenschappelijk Onderzoek
Impressie ACRON symposium 'Lokale Uitvoerbaarheid' van 9 juni jl.
Op 9 juni 2017 vond in Bunnik het ACRON symposium plaats, dat voornamelijk in het teken stond van de verordening (EU) nr. 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik (ECTR) en de lokale beoordelings- of goedkeuringsprocedure in het kader van de 'lokale uitvoerbaarheid'. Het symposium werd mede in samenwerking met de DCRF georganiseerd.
"De deelnemers aan het symposium vormden een divers gezelschap met vertegenwoordigers van ziekenhuizen (NFU en STZ), METCs, geneesmiddelbedrijven en CRO’s en dat leverde hele zinvolle discussies op." (bron: ACRON nieuwsbericht, d.d. 12 juni 2017)
Dat de ontmoeting tussen de 'verschillende werelden' als nuttig werd ervaren blijkt ook uit de terugkoppeling die ik heb ontvangen van een van de aanwezigen op het symposium:
"Wat als heel waardevol is ervaren was de discussie tussen CRO/farma/biotech bedrijven, de mensen van verschillende afdelingen uit verschillende ziekenhuizen en de METC leden. Men ervaart bij de ziekenhuizen terughoudendheid vanuit verschillende afdelingen (oa. radiologie, laboratoria, apotheek) om te veranderen en naar meer standaardisatie toe te gaan leven met als doel klinische proeven te faciliteren zodat deze snel van start kunnen gaan. Maar ook de farmaceutische industrie zal meer flexibiliteit moeten tonen, zoals bij het aannemen van de standaard Clinical Trial Agreement. Kortom, er is nog een hoop werk aan de winkel. Het is dus van belang dat alle betrokken partijen, met hetzelfde doel voor ogen, met elkaar in gesprek blijven. Dat ze begrip hebben voor elkanders positie maar elkaar ook blijven uitdagen mee te gaan in deze verandering. En als de verschillende partijen elkaar ook de helpende hand reiken wanneer dat nodig is, dan zou het wel eens heel snel kunnen gaan."
Naast een kort verslag op de website van de Associatie van Contract Research Organisaties in Nederland (ACRON) is er inmiddels ook een nieuwsbericht over het symposium verschenen op de website van de Vereniging Innovatieve Geneesmiddelen.
Lees verder ACRON nieuwsbericht
Lees verder Vereniging Innovatieve Geneesmiddelen nieuwsbericht
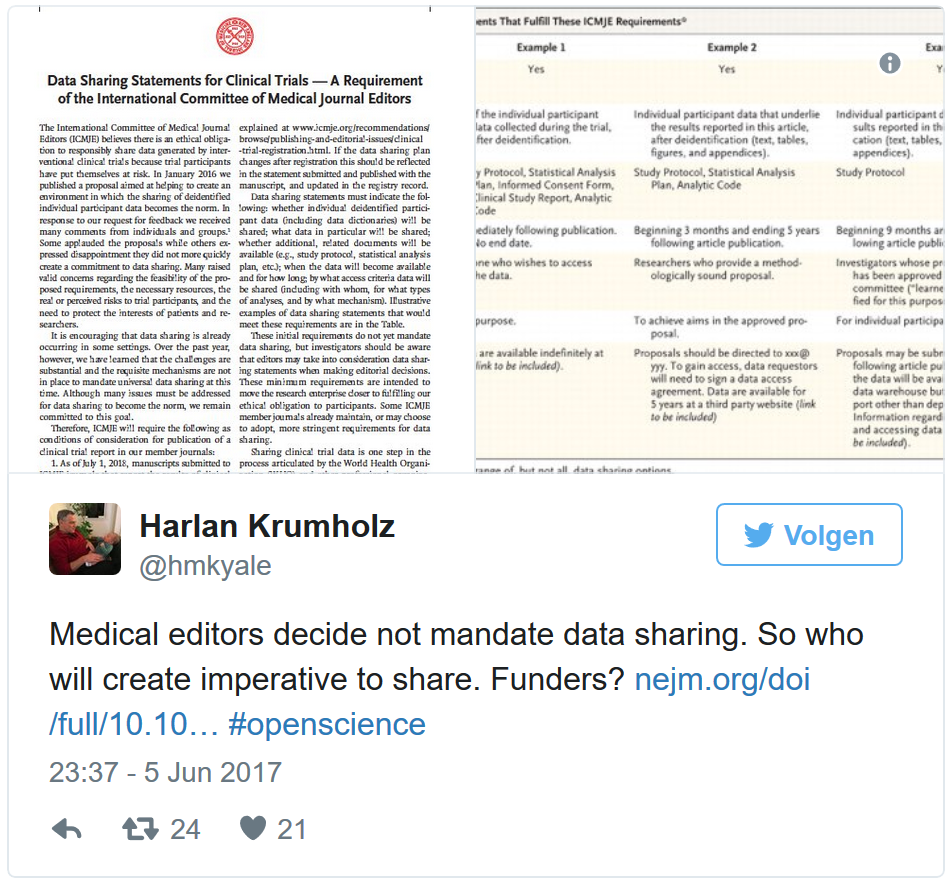
Nieuwe ICMJE vereisten omtrent delen van onderzoeksdata: 'data sharing statement' en 'data sharing plan'
Via een artikel, dat tegelijkertijd in dertien wetenschappelijke tijdschriften is gepubliceerd, heeft het International Committee of Medical Journal Editors (ICMJE) op 6 juni 2017 de nieuwe ICMJE vereiste omtrent het delen van onderzoeksdata bekend gemaakt.
Download de nieuwe ICMJE vereisten
Kritieken op nieuwe ICJME vereisten
De nieuwe ICJME vereisten omtrent het delen van onderzoeksdata zijn een nieuwe stap in de juiste richting. Maar er is ook kritiek. Het had wel iets ambitieuzer gemogen.
Verplicht delen van onderzoeksdata, maar wie gaat het verplichten en wie gaat het handhaven?
Het delen van onderzoeksdata moet de norm worden. De vraag is alleen wie gaat het verplichten en wie gaat de naleving van de norm handhaven?
"Although universal compliance with the requirement to prospectively register clinical trials has not yet been achieved and requires continued emphasis, we must work toward fulfilling the other steps of best practice as well—including data sharing." (bron: Taichman DB, Sahni P, Pinborg A, Peiperl L, Laine C, James A, et al., 2017)
Zelfs het prospectief registreren van een klinische proef in een clinical trial register blijkt nog lang niet altijd goed te gaan, ook al zijn er bij de klinische proef veel verschillende partijen betrokken. Terecht merkt het ICMJE op dat er meer samenwerking nodig is tussen deze verschillende partijen die vaak los van elkaar te werk gaan.
"As we move forward into this new norm where data are shared, greater understanding and collaboration among funders, ethics committees, journals, trialists, data analysts, participants, and others will be required." (bron: Taichman DB, Sahni P, Pinborg A, Peiperl L, Laine C, James A, et al., 2017).
Open Science in Nederland
Nederland is met het National Plan Open Science al een stap verder dan het ICMJE.
Gerelateerd
|
Editorial. Empty rhetoric over data sharing slows science. Nature 546, 327 (15 June 2017) doi:10.1038/546327a |
|
European Medicines Agency - Clinical data |
|
Grechkin M, Poon H, Howe B (2017) Wide-Open: Accelerating public data release by automating detection of overdue datasets. PLOS Biology 15(6): e2002477. |
|
Wide-Open: Datasets overdue for publication in GEO repository (Updated 8 June 2017) [GEO: Gene Expression Omnibus] |
|
Chawla, D.S. (8 June 2017). Text-mining tool seeks out ‘hidden data’. Nature doi:10.1038/nature.2017.22132 |
|
Rosenbaum, L. (8 June 2017). Bridging the Data-Sharing Divide — Seeing the Devil in the Details, Not the Other Camp. N Engl J Med 2017; 376:2201-2203 DOI: 10.1056/NEJMp1704482 |
|
Sansone, S., et al. (6 June 2017). DATS, the data tag suite to enable discoverability of datasets. Scientific Data 4, doi:10.1038/sdata.2017.59 |
|
Taichman Darren B, Sahni Peush, Pinborg Anja, Peiperl Larry, Laine Christine, James Astrid et al. Data sharing statements for clinical trials BMJ 2017; 357 :j2372 XXX |
|
Cañada, A., Capella, S., Rabal, O., Valencia, A., and Martin Krallinger, M.* (2017). LimTox: a web tool for applied text mining of adverse event and toxicity associations of compounds, drugs and genes. Nucleic Acids Research, 7 Web Server Issue, doi: 10.1093/nar/gkx462 |
|
Centro Nacional de Investigaciones Oncológicas press release (31 May 2017). CNIO presents an online tool to extract drug toxicity information from text. |
|
LimTox (text mining for toxicology) |
|
SPARC Europe & DCC (May 2017). An Analysis of Open Data and Open Science Policies in Europe. |
|
Government of the Netherlands News item (30 mei 2017). Germany and the Netherlands call for rapid action on the European Open Science Cloud. |
|
Ester A. Rake, Marleen M. H. J. van Gelder, David C. Grim, Barend Heeren, Lucien J. L. P. G. Engelen, and Tom H. van de Belt, Personalized Consent Flow in Contemporary Data Sharing for Medical Research: A Viewpoint, BioMed Research International, vol. 2017, Article ID 7147212, 4 pages, 2017. |
|
DeHaven, A. (23 May 2017). Preregistration: A Plan, Not a Prison. Center for Open Science, blog. |
|
Giofrè D, Cumming G, Fresc L, Boedker I, Tressoldi P (2017) The influence of journal submission guidelines on authors' reporting of statistics and use of open research practices. PLOS ONE 12(4): e0175583. |
|
Zook M, Barocas S, boyd d, Crawford K, Keller E, et al. (2017) Ten simple rules for responsible big data research. PLOS Computational Biology 13(3): e1005399. |
Vanaf 19 juni gefaseerde vernieuwing ClinicalTrials.gov
Op 19 juni 2017 zal de vernieuwde ClinicalTrials.gov website online gaan. Het online gaan van de nieuwe versie markeert tevens het begin van een revisieproces dat nader wordt toegelicht in een Technical Bulletin notice:
"Beginning June 19, 2017, ClinicalTrials.gov will undergo a series of changes focused on improving the ability to search, display, and review information about clinical research studies registered with the site. ... Additional designs and features will be evaluated on a new version of the beta site over the next few months. Changes will be introduced on ClinicalTrials.gov as they are ready, following testing and validation. It is anticipated that the most significant set of changes will be available on ClinicalTrials.gov in September 2017." (bron: Wolf K, Ide N, Koufopoulos J, Williams RJ, Tse T. ClinicalTrials.gov: First in a Series of Changes to Improve Usability for Stakeholders. NLM Tech Bull. 2017 May-Jun;(416):e4.)
Voorbereiding AMvB openbaarmakingsbeleid inspectiegegevens vraagt meer tijd
De minister van Volksgezondheid, Welzijn en Sport, (VWS) heeft op 7 juni 2017 in een brief de Tweede Kamer laten weten dat de voorbereiding van de algemene maatregel van bestuur (AMvB) betreffende het beleid ten aanzien van het openbaar maken van inspectiegegevens meer tijd vraagt en dat het ontwerp van de AMvB niet meer voor het zomerreces aan de Kamer kan worden voorgehangen.
"Nog voor de plenaire behandeling is aan uw Kamer toegezegd (kst. 34111, nr. 6, p 8) dat, zodra een ontwerp van de amvb in consultatie gaat, ik uw Kamer het ontwerp zal toesturen. Nu tijdens de plenaire behandeling van het wetsvoorstel tot wijziging van de Gezondheidswet door middel van een amendement in de wet is opgenomen dat voorhang dient plaats te vinden, gebeurt dit automatisch." (bron: Brief regering, d.d. 7 juni 2017)
De minister van VWS verwacht dat voor het einde van het zomerreces de internetconsultatie over de ontwerp AMvB van start zal gaan.
Presentaties van de NVFG ClinOpsDag 2017 zijn beschikbaar
Op 20 april 2017 vond in Veenendaal de NVFG ClinOpsDag plaats. De presentaties die tijdens de dag zijn gehouden zijn inmiddels te downloaden via de website van de ClinOpsDag.
Alleen de presentatie van Joost Huiskens (TrialApp), met de titel “Op zoek naar de optimale driehoeksverhouding tussen zorg, research en technologie”, ontbreekt (nog).
Breng uw nieuws, artikel of activiteit onder de aandacht van de lezers van de nieuwsbrief
Wilt u een activiteit, een nieuwsbericht of een artikel onder de aandacht brengen van de lezers van de Nieuwsbrief voor Goede Onderzoekspraktijken?
Verstuur uw bijdrage voor de eerstvolgende uitgave van de Nieuwsbrief voor Goede Onderzoekspraktijken per e-mail naar info [at] bontrop.com of via het formulier op de website.
Eventuele voorwaarden zijn opvraagbaar via hetzelfde e-mailadres.
Onderzoek met Geneesmiddelen
Inwerkingtreding EU verordening nr. 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik uitgesteld naar 2019
Op 14 en 15 juni 2017 heeft de bestuursvergadering van het EMA plaatsgevonden, waarin onder meer gesproken is over de stand van zaken ten aanzien van de ontwikkeling van de EU clinical trial portal.
Gebleken is dat "[d]ue to technical difficulties with the development of the IT systems, the portal’s go-live date has to be postponed" (bron: EMA Management Board, Highlights of June 2017 meeting).
Het uitstellen van de oplevering van de EU clinical trial portal heeft mede tot gevolg dat verordening (EU) nr. 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik niet in oktober 2018 in werking kan treden maar pas in 2019.
In de volgende bestuursvergadering van het EMA in oktober zal er naar alle waarschijnlijkheid een nieuw tijdschema voor de aflevering van de portal worden gepresenteerd.
De Centrale Commissie Mensgebonden Onderzoek (CCMO) heeft inmiddels laten weten dat zij "... onderzoekt of de vertraging gevolgen heeft voor de lopende activiteiten die de CCMO in gang heeft gezet om Nederland voor te bereiden op de nieuwe Europese wetgeving voor geneesmiddelenonderzoek" (bron: CCMO nieuwsbericht d.d. 16 juni 2017)
Gereviseerde ICH-GCP richtsnoer per 14 juni 2017 van toepassing binnen de Europese Unie
Voor wie het heeft gemist (zie bijv. Nieuwsbrief voor Goede Onderzoekspraktijken nr. 16 van 7 januari 2017), sinds 14 juni 2017 is de gereviseerde ICH E6 (R2) Good clinical practice richtsnoer van toepassing binnen de Europese Unie.
Onderzoek met Lichaamsmateriaal ~ Biobanking
In het licht van de consultatie Wet zeggenschap lichaamsmateriaal
De einddatum voor de consultatie voor de Wet zeggenschap lichaamsmateriaal komt in zicht (einddatum 23 juni 2017, nog 4 dagen!). Inmiddels zijn er reeds 117 openbare reacties ingediend (dat is excl. de niet-openbare reacties).
Daarom, als laatste aanvulling op het bericht in de Nieuwsbrief voor Goede Onderzoekspraktijken nr. 31 van 8 mei 2017, hierbij nog een overzicht van recent verschenen artikelen en opinies.
|
Van Lessen Kloeke, K. (8 juni 2017). Presentatie: Ontwerp Wet zeggenschap lichaamsmateriaal (Wzl). Vakgroep J&C Overleg – Vereniging Innovatieve Geneesmiddelen Den Haag. |
|
Van Eijck, B. (7 juni 2017). DNA vrijgeven tast rechtspositie ziekenhuizen aan. Medisch Contact. |
|
Rechter wijst DNA-test donorkinderen toe (2 juni 2017). ANP (via Medisch Contact) |
|
Van Houdenhoven, M. (2 juni 2017). Genen: Wat nu?. Medisch Contact blog. |
|
Engelfriet, A. (31 mei 2017). Juridische vraag: Is biometrische identificatie onder de Privacyverordening (AVG) nog wel toegestaan?. Security.nl |
|
Stoffelen, A. (30 mei 2017). Primeur: kind van anonieme spermadonor vindt vader via commerciële dna-databank. De Volkskrant. |
|
Keulemans, M. (29 mei 2017). Nieuwe techniek kan huidskleur achterhalen bij dna-onderzoek na misdrijf. De Volkskrant. |
|
Nieuwsredactie (29 Mei 2017). Zaak Utrechtse serieverkrachter: justitie overwoog DNA-onderzoek opgeslagen hielprikjes. RTV Utrecht. |
|
Kretchmer, H. (25 May 2017). Ancestry.com denies exploiting users' DNA. BBC News. |
|
Zarate, O. A., Brody, J. G., Brown, P., Ramirez-Andreotta, M. D., Perovich, L. and Matz, J. (2016), Balancing Benefits and Risks of Immortal Data. Hastings Center Report, 46: 36–45. doi:10.1002/hast.523 |
|
Nobile, H., Bergmann, M.M., Moldenhauer, J. & Borry, P. (4 July 2016). Participants’ Accounts on Their Decision to Join a Cohort Study With an Attached Biobank. Journal of Empirical Research on Human Research Ethics Vol 11, Issue 3, pp. 237 - 249. |
|
Council of Europe. Recommendation CM/Rec(2016)6 of the Committee of Ministers to member States on research on biological materials of human origin. (Adopted by the Committee of Ministers on 11 May 2016 at the 1256th meeting of the Ministers’ Deputies) |
20 juni 2017 - EUPATI Webinar: Guidance for Patient Involvement in Regulatory Processes
Webinar vindt plaats op 20 juni 2017 van 17:00 tot 18:30 CET.
Registreren via de website van EUPATI.
23 juni 2017 - DARQA café: QA in control
Locatie: Regardz De Eenhoorn, Amersfoort
Tot 25 juni 2017 - Trust Me, I’m an Artist - groepstentoonstelling (kunst, project, Waag society)
Locatie: Het Glazen Huis, Amstelpark, Amsterdam
27 juni 2017 - Congres: ‘Nederland wereldleider proefdiervrije innovatie’
Georganiseerd door Ministerie van Economische Zaken, ZonMw, KNAW, NCad, RIVM.
Locatie: Nieuwegein
28 juni 2017 - Webinar: GRADE for preclinical animal studies: translating evidence from bench to bedside (17.00 CET)
Organized by ECNP Preclinical Data Forum Network and Hosted by Cohen Veterans Bioscience.
18 - 19 september 2017 - ASTERIX End Symposium, advances in small trials design for regulatory innovation and excellence
Locatie: Inntel Hotel Zaandam, Zaandam
2 - 4 oktober 2017 - KVCV - Workshop GLP: Development, implementation and follow-up of a GLP quality system
Locatie: Gent, België
14 november 2017 - EMA: Joint European Medicines Agency / Drug Information Association information day on measuring the impact of pharmacovigilance activities
Locatie: European Medicines Agency, London
LET OP! Aanmelden kan tot 31 oktober 2017
2 - 4 mei 2018 - IHI & BMJ - International Forum on Quality and Safety in Healthcare
Locatie: Amsterdam
3 - 6 mei 2018 - Open Knowledge Festival - #OKFest
Locatie: Thessaloniki, Griekenland
Cooperation And Liaison Between Universities And Editors (CLUE): Recommendations On Best Practice
Reacties/vragen via liz@sideview.demon.co.uk
CDISC: Public Review version 1.6 of the Study Data Tabulation Model Document (SDTM)
Consultatie open tot 24 juni 2017
CDISC: Duchenne Muscular Dystrophy Therapeutic Area User Guide Available for Public Review
Consultatie open tot 6 juli 2017
WHO: Guidance on Good Practices for desk assessment for compliance with GMP, GLP And GCP for marketing authorization of Medical Products (QAS/17.713)
Consultatie open tot 15 juli 2017
EMA: Concept paper on a guideline on the evaluation of medicinal products indicated for treatment of influenza
Consultatie open tot 31 juli 2017
EMA: Concept paper on the need for the development of a reflection paper on regulatory requirements for the development of medicinal products for chronic non-infectious liver diseases (PBC, PSC, NASH)
Consultatie open tot 31 augustus 2017
Meer bijeenkomsten en consultaties?
Voor meer bijeenkomsten en lopende publieke consultaties zie:
Het eerstvolgende maandelijkse overzicht met bijeenkomsten en consultaties (uitgave juni 2017) zal worden verstuurd op 1 juli 2017.
Ontvangt u het maandelijkse overzicht met bijeenkomsten en publieke consultaties nog niet? Klik dan hier om uw voorkeuren aan te passen
|
Schoenfeld AJ, Redberg RF. The Value of Using Registries to Evaluate Randomized Clinical Trial Study Populations. JAMA Intern Med. 2017;177(6):889. doi:10.1001/jamainternmed.2017.0761 |
|
McCook, A. (15 June 2017). Meet PubPeer 2.0: New version of post-publication peer review site launches today. Retraction Watch. |
|
Campbell Marion K, Weijer Charles, Goldstein Cory E, Edwards Sarah J L. Do doctors have a duty to take part in pragmatic randomised trials? BMJ 2017; 357 :j2817 |
|
Giffen CA, Wagner EL, Adams JT, Hitchcock DM, Welniak LA, et al. (2017) Providing researchers with online access to NHLBI biospecimen collections: The results of the first six years of the NHLBI BioLINCC program. PLOS ONE 12(6): e0178141. |
|
Sekula P, Mallett S, Altman DG, Sauerbrei W (2017) Did the reporting of prognostic studies of tumour markers improve since the introduction of REMARK guideline? A comparison of reporting in published articles. PLOS ONE 12(6): e0178531. |
|
Dyer, O. (14 June 2017). Drugs with FDA accelerated approval often have weak evidence, study finds. BMJ 2017;357:j2905 |
|
Kalichman, M.W. & Plemmons, D.K. (2017). Intervention to Promote Responsible Conduct of Research Mentoring. Sci Eng Ethics. doi:10.1007/s11948-017-9929-8 |
|
McCook, A. (9 June 2017). Journal won’t look at allegations about papers more than six years old, nor comment on those from “public websites”. Retraction Watch. |
|
Regalado, A. (9 June 2017). Gene Editing Companies Hit Back at Paper That Criticized CRISPR. MIT Technology Review. |
|
Van Esbroeck, A.C.M. (9 June 2017). Activity-based protein profiling reveals off-target proteins of the FAAH inhibitor BIA 10-2474, Science Vol. 356, Issue 6342, pp. 1084-1087 |
|
Feldwisch-Drentrup , H. (8 June 2017). New clues to why a French drug trial went horribly wrong. Science. DOI: 10.1126/science.aan6949 |
|
Everts, S. (8 June 2017). Revisiting what went wrong in the clinical trial tragedy in France. Chemical & Engineering News. |
|
Bram Duyx, Miriam J.E. Urlings, Gerard M.H. Swaen, Lex M. Bouter, Maurice P. Zeegers, Scientific Citations Favor Positive Results: A Systematic Review and Meta-analysis, Journal of Clinical Epidemiology, Available online 8 June 2017, ISSN 0895-4356 |
|
Dechartres Agnes, Trinquart Ludovic, Atal Ignacio, Moher David, Dickersin Kay, Boutron Isabelle et al. Evolution of poor reporting and inadequate methods over time in 20 920 randomised controlled trials included in Cochrane reviews: research on research study BMJ 2017; 357 :j2490 |
|
CBG Nieuwsbericht (8 juni 2017). MEB Annual Report: a leading player in Europe again in 2016. |
|
EuropeBio press release (6 June 2017). EuropaBio launches recommendations to enhance transparency of biosimilar labels. |
|
Wright, E. & Maria Chaita, M. (7 June 2017). Personalised Medicines at the top of the European Agenda. Hogan Lovells, Focus on Regulation blog. |
|
Laufer Halpin, A. (7 June 2017). Precision Public Health: Harnessing the Power of the Human Microbiome. CDC, Genomics and Health Impact Blog. |
|
Masters A, Nutt DA Plutocratic Proposal: an ethical way for rich patients to pay for a place on a clinical trial Journal of Medical Ethics Published Online First: 06 June 2017. doi: 10.1136/medethics-2016-104050 |
|
ZonMw Subsidieoproep: Investeringen Middelgroot 2017-2018 (Onderzoekers kunnen met behulp van het programma Investeringen Middelgroot apparatuur aanschaffen en dataverzamelingen opzetten, koppelen en verrijken) |
|
CBG nieuwsbericht (6 juni 2017). Nieuwe verplichtingen rond EudraVigilance vanaf 22 november 2017. |
|
Schellekens, H., Aldosari, M., Talsma, H. & Mastrobattista, E. (5 June 2017). Making individualized drugs a reality. Nature Biotechnology doi:10.1038/nbt.3888 |
|
Hakala, A. K., Fergusson, D. and Kimmelman, J. (2017), Nonpublication of trial results for new neurological drugs: A systematic review. Ann Neurol.. doi:10.1002/ana.24952 |
|
Jonathan Kimmelman. (5 June 2017). Nonpublication of Neurology Trials for Stalled Drugs & the Ironic Nonpublication of Data on those Stalled Drugs. Studies of Translation, Ethics and Medicine (STREAM), blog. |
|
Glasziou, P. & Chalmers, I. (5 June 2017). Can it really be true that 50% of research is unpublished? BMJ Opinion blogs, The BMJ. |
|
Brown, N. (7 June 2017). Exploring John Carlisle's "bombshell" article about fabricated data in RCTs. Nick Brown's blog. |
|
Carlisle, J. B. (2017), Data fabrication and other reasons for non-random sampling in 5087 randomised, controlled trials in anaesthetic and general medical journals. Anaesthesia. doi:10.1111/anae.13938 |
|
Loadsman, J. A. and McCulloch, T. J. (2017), Widening the search for suspect data – is the flood of retractions about to become a tsunami?. Anaesthesia. doi:10.1111/anae.13962 |
|
Sharma, D.K., et al. (5 June 2017). Building a semantic web-based metadata repository for facilitating detailed clinical modeling in cancer genome studies. Journal of Biomedical Semantics 2017 8:19, DOI: 10.1186/s13326-017-0130-4 |
|
EU Commission Issues Questionnaire in Preparation for Annual Review of Privacy Shield. Privacy & Information Security Law Blog (5 June 2017). |
|
Ridgeon, E.E., et al. (5 June 2017). Effect sizes in ongoing randomized controlled critical care trials. Critical Care 2017 21:132, DOI: 10.1186/s13054-017-1726-x |
|
Carroll C, Hassanin A. Polypharmacy in the Elderly—When Good Drugs Lead to Bad Outcomes A Teachable Moment. JAMA Intern Med. 2017;177(6):871. doi:10.1001/jamainternmed.2017.0911 |
|
The Biobanking Boom (2 June 2017). BioSpectrum Asia edition. |
|
Gibson, C. Michael et al. (2017). When academic research organizations and clinical research organizations disagree: Processes to minimize discrepancies prior to unblinding of randomized trials. American Heart Journal , Volume 189 , 1 - 8 |
|
Hyder, A., Deutsch-Feldman, M., Ali, J., Sikateyo, B., Kass, N. & Michelo, C. (2017). Rapid Assessment of Institutional Research Ethics Capacity: A Case Study from Zambia. Acta Bioethica 2017; 23 (1): 35-46 |
|
Drug Discovery Today, Volume 22, Issue 6, Pages 835-964, June 2017 |
|
ECHA news (1 June 2017). Alternatives to animal testing widely used. |
|
Marselis, D. (1 juni 2017). De patentoorlog. Ned Tijdschr Geneeskd. 2017;161:C3482 |
|
Harrell, F. & Lazzeroni, L. (1 June 2017). EHRs and RCTs: Outcome Prediction vs. Optimal Treatment Selection. Statistical Thinking blog. |
|
Aan de Brugh, M. (1 juni 2017). De wetenschap is niet zelfzuiverend. NRC |
|
Health Care Industry Cybersecurity Task Force (June 2017). Report on Improving Cybersecurity in the Health Care Industry. [Task Force ingesteld door U.S. Department of Health & Human Services] |
|
Kurahashi, M., Murao, K., Terada, T. & Tsukamoto, M. (z.d.). Personal Identification System Based on Rotation of Toilet Paper Rolls. |
|
Tweede Kamer (31 mei 2017). Organisatorische vertaling Verordening & Richtlijn [Gegevensbescherming] |
|
Zuiderveen Borgesius, F., Van Hoboken, J., Fahy, R., Irion, K. & Rozendaal, M. (May 2017). An assessment of the Commission’s Proposal on Privacy and Electronic Communications. |
|
EMA News (31 May 2017). Regulatory guidance for industry to prepare for the UK’s withdrawal from the EU. |
|
Cookson, E. (31 May 2017). Clinical trials in the twenty first century – highlights from ICTMC 2017. BMC Series Blog, BioMed Central |
|
Cobey KD, Galipeau J, Shamseer L, Moher D. (2017) Assessing the utility of an institutional publications officer: a pilot assessment. PeerJ 5:e3294 |
|
EMA (31 May 2017). New action plan to support SMEs as drivers of pharmaceutical innovation. |
|
Rankin, J., Ross, A., Baker, J., O'Brien, M., Scheckel, C. and Vassar, M. (2017), Selective outcome reporting in obesity clinical trials: a cross-sectional review. Clin Obes. doi:10.1111/cob.12199 |
|
Turnbull AE, Hashem MD, Rabiee A, To A, Chessare CM, et al. (2017) Evaluation of a strategy for enrolling the families of critically ill patients in research using limited human resources. PLOS ONE 12(5): e0177741. |
|
European Commission. Adoption of the Commission decision on the qualification of cranberry products. (Last update: 30/05/2017) |
|
National Institute for Health and Care Excellence (30 May 2017). NICE to launch new evidence tool for medtech product developers. |
|
List, B. (30 May 2017). Crowd-based peer review can be good and fast. Nature 546, 9 doi:10.1038/546009a |
|
Davis, P. (30 May 2017). How Much Citation Manipulation Is Acceptable?. The Scholary Kitchen. |
|
Papadaki M (29 May 2017) Adaptation through Collaboration: Developing Novel Platforms to Advance the Delivery of Advanced Therapies to Patients. Front. Med. 4:56. doi: 10.3389/fmed.2017.00056 |
|
McCook, A. (29 May 2017). It’s not just whistleblowers who deserve protection during misconduct investigations, say researchers. Retraction Watch. |
|
Nieuwsbericht (29 mei 2017). CBG start op 1 juni 2017 met technische validatie elektronische indiening. |
|
Vaught, M., Jordan, D.C. & Bastian, H. (27 May 2017). Concern noted: a descriptive study of editorial expressions of concern in PubMed and PubMed Central. Research Integrity and Peer Review 2017 2:10 DOI: 10.1186/s41073-017-0030-2 |
|
Boyd K. (26 May 2017). Competence, Consent and Complexity. Journal of Medical Ethics 2017;43:351-352. |
|
European Commission (25 May 2017). One year to go until the new EU data protection rules. |
|
Waltman, L. & Traag, V. (25 May 2017). Impact factors: Is the Nature Index at odds with DORA?. Nature 545, 412 doi:10.1038/545412a |
|
Mengjie (25 May 2017). China vows zero tolerance towards academic fraud. Xinhuanet. |
|
Czifra-Tóth, E. & Tennant, J. (24 May 2017). A number of freely available tools can help you improve your literature review routine and stay on top of published research. LSE Impact Blog. |
|
Clinical Trials Transformation Initiative news (24 May 2017). CTTI Launches New Project to Improve Process for Qualifying Investigators to Conduct Clinical Trials. |
|
Mastroianni, A. C., Henry, L. M., Robinson, D., Bailey, T., Faden, R. R., Little, M. O. and Lyerly, A. D. (2017), Research with Pregnant Women: New Insights on Legal Decision-Making. Hastings Center Report, 47: 38–45. doi:10.1002/hast.706 |
|
Sugarman, J. & Stolbach, A. J. Ethics and Medical Toxicology Research. Med. Toxicol. (2017). doi:10.1007/s13181-017-0618-4 |
|
Van Hintum, M. (23 mei 2017). Uit mijn hoofd. Zelfs de hersenen zijn voor hackers niet meer veilig. De Groene Amsterdammer. |
|
Medicines for Europe (23 May 2017). EU Semester Country Specific Recommendations: More Efficient Medicine Policies Needed for Patient Access |
|
Rios, B. (23 May 2017). Understanding Pacemaker Systems Cybersecurity. WhiteScope IO, blog. |
|
Clinical Trials Transformation Initiative news (23 May 2017). New CTTI Recommendations Provide Path for More Efficient Clinical Trials Using Clinical Registries. |
|
Puljak L, Marin A, Vrdoljak D, Markotic F, Utrobicic A, Tugwell P. (22 May). Celecoxib for osteoarthritis. Cochrane Database of Systematic Reviews 2017, Issue 5. Art. No.: CD009865. DOI: 10.1002/14651858.CD009865.pub2. |
|
Fareen Parvez, Z. (22 May 2017). People Don’t Trust Scientific Research When Companies Are Involved. Elsevier SciTech Connect. |
|
Marcia McNutt, Monica Bradford, Jeffrey Drazen, R. Brooks Hanson, Bob Howard, Kathleen Hall Jamieson, Veronique Kiermer, Michael Magoulias, Emilie Marcus, Barbara Kline Pope, Randy Schekman, Sowmya Swaminathan, Peter Stang, Inder Verma (20 May 2017). Transparency In Authors' Contributions And Responsibilities To Promote Integrity In Scientific Publication. bioRxiv 140228 |
|
Shamseer, L. (19 May 2017). CONSORT and reporting trials in 2017: who should do what. On Medicine, blog network. BioMed Central. |
|
Martin, L., Hutchens, M., Hawkins, C. & Radnov, A. (19 May 2017). How much do clinical trials cost?. Nature Reviews Drug Discovery 16, 381–382 doi:10.1038/nrd.2017.70 |
|
Boyer, S., et al. (18 May 2017). Percentage-Based Author Contribution Index. A Universal Measure Of Author Contribution To Scientific Articles. bioRxiv 138875 (preprint and has not been peer-reviewed) |
|
ZonMw nieuwsbericht (17 mei 2017). Belang van onderzoek naar wilsbekwaamheid van kinderen. |
|
Fineberg HV. (2 May 2017). Conflict of Interest Why Does It Matter?. JAMA. 2017;317(17):1717-1718. doi:10.1001/jama.2017.1869 |
|
Sharfstein JM, Stebbins M. Enhancing Transparency at the US Food and Drug Administration. Moving Beyond the 21st Century Cures Act. JAMA. 2017;317(16):1621-1622. doi:10.1001/jama.2017.2481 |
|
Xavier Kurz, Vincent Bauchau, Patrick Mahy, Steffen Glismann, Lieke Maria van der Aa, François Simondon, The ADVANCE Code of Conduct for collaborative vaccine studies, Vaccine, Volume 35, Issue 15, 4 April 2017, Pages 1844-1855, ISSN 0264-410X |
|
Stephen A. Roberts, Andy Vail; On the appropriate interpretation of evidence: the example of culture media and birth weight. Hum Reprod 2017; 32 (6): 1151-1154. doi: 10.1093/humrep/dex081 |
|
Szucs D, Ioannidis JPA (2 March 2017) Empirical assessment of published effect sizes and power in the recent cognitive neuroscience and psychology literature. PLOS Biology 15(3): e2000797. |
|
van Deudekom FJ, Postmus I, van der Ham DJ, Pothof AB, Broekhuizen K, et al. (2017) External validity of randomized controlled trials in older adults, a systematic review. PLOS ONE 12(3): e0174053 |
|
National Academies of Sciences, Engineering, and Medicine. 2017. Fostering Integrity in Research. Washington, DC: The National Academies Press. doi:https://doi.org/10.17226/21896. |
|
UK Research Integrity Office (UKRIO). Guidance notes and position statements. |
|
Glasziou P, Aronson JK (2017). A brief history of clinical evidence updates and bibliographic databases. JLL Bulletin: Commentaries on the history of treatment evaluation. The James Lind Library. |
|
Domecq, J.P., et al. (26 February 2014). Patient engagement in research: a systematic review. BMC Health Services Research 2014 14:89, DOI: 10.1186/1472-6963-14-89 |
Copyright © Vincent Bontrop, All rights reserved.
Contactgegevens:
Hopakker - 3514 BZ Utrecht - Netherlands
 |
 |