|
||||
Beste lezer,
Hierbij ontvangt de Nieuwsbrief voor Goede Onderzoekspraktijken van 24 oktober 2017, met de laatste ontwikkelingen rond medisch-wetenschappelijk onderzoek met mensen, nieuwe wetgeving en gereviseerde richtlijnen.
Met vriendelijke groet,
Inhoudsopgave
- DCRF werkt aan nieuwe versie template Clinical Trial Agreement
- Nationaal Ethiek Overleg Sociale en Gedragswetenschappen
- Presentaties van het DCRF jaarcongres 2017 zijn beschikbaar
- Uitgelicht: Algemene Verordening Gegevensbescherming (AVG)
- EudraVigilance van 8 tot en met 21 november 2017 buiten gebruik
- Combineren van de voortgangsrapportage met de veiligheidsrapportage bij geneesmiddelenonderzoek
- Deelname aan meerdere onderzoeken: ACRON heeft nieuw systeem gevonden voor preventie van 'overvolunteering'
- Minister VWS heeft een terugkoppeling gegeven van de ronde tafel bijeenkomst die was georganiseerd naar aanleiding van de motie 'leidende rol bij geneesmiddelenonderzoek met vrouwen en comorbide patiënten' van het lid Rutte
- Europese Commissie heeft de gereviseerde 'Ethical considerations for clinical trials on medicinal products conducted with minors' gepubliceerd
- EMA publiceert ICH E11(R1) step 5 guideline on clinical investigation of medicinal products in the pediatric population
- EMA publiceert ICH E18 Guideline on genomic sampling and management of genomic data
- Definitieve versie van concept Procedure Lokale Haalbaarheid gepubliceerd
- ACRON betrokken bij ontwikkeling EU portal voor klinische proeven met geneesmiddelen voor menselijk gebruik
- Gereviseerde EMA 'External guidance on the implementation of the European Medicines Agency policy on the publication of clinical data for medicinal products for human use' gepubliceerd
- De doelmatigheid en transparantie van geneesmiddelenonderzoek
- IGJ rapport Cryoballonkatheter Erasmus MC gepubliceerd
- Bijeenkomsten
- Publieke consultaties
- Uitgelicht
Medisch Wetenschappelijk Onderzoek
DCRF werkt aan nieuwe versie template Clinical Trial Agreement
Op 16 oktober 2017 is op de website van de Associatie van Contract Research Organisaties in Nederland (ACRON) een introductie van de CTA Werkgroep gepubliceerd waaruit blijkt dat er momenteel wordt gewerkt aan een nieuwe versie van de template Clinical Trial Agreement (CTA).
Volgens de introductie van de CTA Werkgroep op de ACRON website wordt er onder meer gekeken naar:
- Fair Market Value budget
- Update van de definities van de verschillende partijen
- Toegang tot het EPD door de monitor (verklaring confidentiality agreement met werkgever)
Er is niet aangegeven wanneer de nieuwe versie van de template CTA gereed is. Aangezien de CTA Werkgroep maar eenmaal per kwartaal bijeenkomt is het niet mijn verwachting dat de nieuwe versie nog dit jaar gereed zal zijn.
Nationaal Ethiek Overleg Sociale en Gedragswetenschappen
De lokale ethische commissies van de faculteiten sociale wetenschappen hebben zich verenigd in het Nationaal Ethiek Overleg Sociale en Gedragswetenschappen.
"Het Nationaal Ethiek Overleg Sociale en Gedragswetenschappen heeft als doel om tot gezamenlijke waarden en principes te komen die gelden voor alle aangesloten universitaire faculteiten en onderzoeksinstituten. Ook streeft het nationaal overleg naar kennisontwikkeling en -uitwisseling. Daarnaast vertegenwoordigt het nationaal overleg de ethische commissies bij nationale en internationale organisaties, inclusief de overheid en subsidiegevers." (Bron: website Nationaal Ethiek Overleg Sociale en Gedragswetenschappen).
Presentaties van het DCRF jaarcongres 2017 zijn beschikbaar
De presentaties die gegeven zijn op het jaarcongres van de Dutch Clinical Research Foundation (DCRF) kunnen worden gedownload via de website van de DCRF.
|
EMA News (19 October 2017). Data privacy in the age of big data. |
|
Dickinson, R., Mulryne, J. & Walkinshaw, Z. (28 September 2017). General Data Protection Regulation: The Impact on Clinical Trials and Data Subjects. Clinical Trials Arena. |
|
Stefanelli, S. (7 June 2017). Clinical trials and GDPR. EuroPrivacy [blog]. |
Onderzoek met Geneesmiddelen
EudraVigilance van 8 tot en met 21 november 2017 buiten gebruik
EudraVigilance is vanwege een update buiten gebruik in de periode van 8 tot en met 21 november 2017.
De Centrale Commissie Mensgebonden Onderzoek (CCMO) heeft op haar website instructies geplaatst hoe SUSAR's gemeld moeten worden in de periode dat EudraVigilance niet kan worden gebruikt.
Combineren van de voortgangsrapportage met de veiligheidsrapportage bij geneesmiddelenonderzoek
Op vrijdag 20 oktober 2017 heeft de Centrale Commissie Mensgebonden Onderzoek (CCMO) een nieuwsbericht geplaatst, waarmee ze de mogelijkheid om bij geneesmiddelenonderzoek de jaarlijkse voortgangsrapportage te combineren met de jaarlijkse veiligheidsrapportage expliciet onder de aandacht brengt.
Aangaande de jaarlijkse veiligheidsrapportage, deze dient op grond van artikel 13q van de Wet medisch-wetenschappelijk onderzoek met mensen (WMO) en artikel 6 van de Regeling medisch wetenschappelijk onderzoek, de volgende informatie te bevatten:
- een lijst van alle vermoedens van ernstige bijwerkingen samen met een geaggregeerde samenvattende tabel gevoegd van alle gerapporteerde ernstige bijwerkingen geordend naar orgaansysteem per onderzoek.
- een volledige veiligheidsanalyse en een evaluatie van de balans tussen de werkzaamheid en de schadelijkheid van het geneesmiddel voor onderzoek.
Bij het combineren van de voortgangsrapportage met de veiligheidsrapportage mag, in plaats van de datum van het positieve WMO besluit, de (internationaal) vastgestelde datum voor de jaarlijkse veiligheidsrapportage worden aangehouden (bron: CCMO nieuwsbericht, 20 oktober 2017).
Deelname aan meerdere onderzoeken: ACRON heeft nieuw systeem gevonden voor preventie van 'overvolunteering'
De Associatie van Contract Research Organisaties in Nederland (ACRON) heeft op 16 oktober 2017 laten weten dat zij, samen met onderzoekscentra uit België en Duitsland, een nieuw systeem hebben gevonden voor de preventie van 'overvolunteering' bij onderzoeken met gezonde vrijwilligers.
Minister VWS heeft een terugkoppeling gegeven van de ronde tafel bijeenkomst die was georganiseerd naar aanleiding van de motie 'leidende rol bij geneesmiddelenonderzoek met vrouwen en comorbide patiënten' van het lid Rutte
De minister van Volksgezondheid, Welzijn en Sport (VWS) heeft op 13 oktober 2017 de kamer geïnformeerd over de resultaten van de ronde tafel bijeenkomst, die in opdracht van de minister door de Dutch Clinical Research Foundation (DCRF) was georganiseerd, naar aanleiding van de door het lid Rutte ingediende motie "waarin de regering werd verzocht te onderzoeken op welke manier Nederland een leidende rol bij klinisch geneesmiddelenonderzoek met vrouwen en comorbide patiënten kan krijgen, welke stappen daarvoor nodig zijn en hoe gebruik kan worden gemaakt van de aanwezige kennis, expertise en onderzoeksinfrastructuur" (bron: Brief regering d.d. 13 oktober 2017).
Europese Commissie heeft de gereviseerde 'Ethical considerations for clinical trials on medicinal products conducted with minors' gepubliceerd
De Europese Commissie heeft de gereviseerde 'Ethical considerations for clinical trials on medicinal products conducted with minors (Revision 1, 18 September 2017)' gepubliceerd. De gereviseerde guidance is van toepassing op klinische proeven die onder de reikwijdte van Verordening (EU) nr. 536/2014 vallen.
Zolang de nieuwe EU Clinical Trial Regulation nog niet in werking is getreden dienen de huidige guidance documents aangehouden te worden.
Volgens de Centrale Commissie Mensgebonden Onderzoek (CCMO) blijft "[t]ot die tijd ... het toetsingskader Toetsing van onderzoek met minderjarige proefpersonen – begin 2017 door de NVMETC en de CCMO opgesteld – onverminderd van toepassing in Nederland." (bron: CCMO nieuwsbericht, 20 oktober 2017)
De nieuwe gereviseerde 'Ethical considerations for clinical trials on medicinal products conducted with minors' is, net als de "oude" finale versie uit 2008, te downloaden via EudraLex.
CCMO/NVMETC toetsingskader Toetsing van onderzoek met minderjarige proefpersonen
Download CCMO/NVMETC toetsingskader Toetsing van onderzoek met minderjarige proefpersonen
EMA publiceert ICH E11(R1) step 5 guideline on clinical investigation of medicinal products in the pediatric population
Het European Medicines Agency (EMA) heeft op 6 oktober 2017 de ICH E11(R1) step 5 guideline on clinical investigation of medicinal products in the pediatric population gepubliceerd.
De guideline treedt op 28 februari 2017 in werking.
EMA publiceert ICH E18 Guideline on genomic sampling and management of genomic data
Het European Medicines Agency (EMA) heeft op 6 oktober 2017 de ICH E18 Guideline on genomic sampling and management of genomic data
gepubliceerd.
De guideline treedt op 28 februari 2017 in werking.
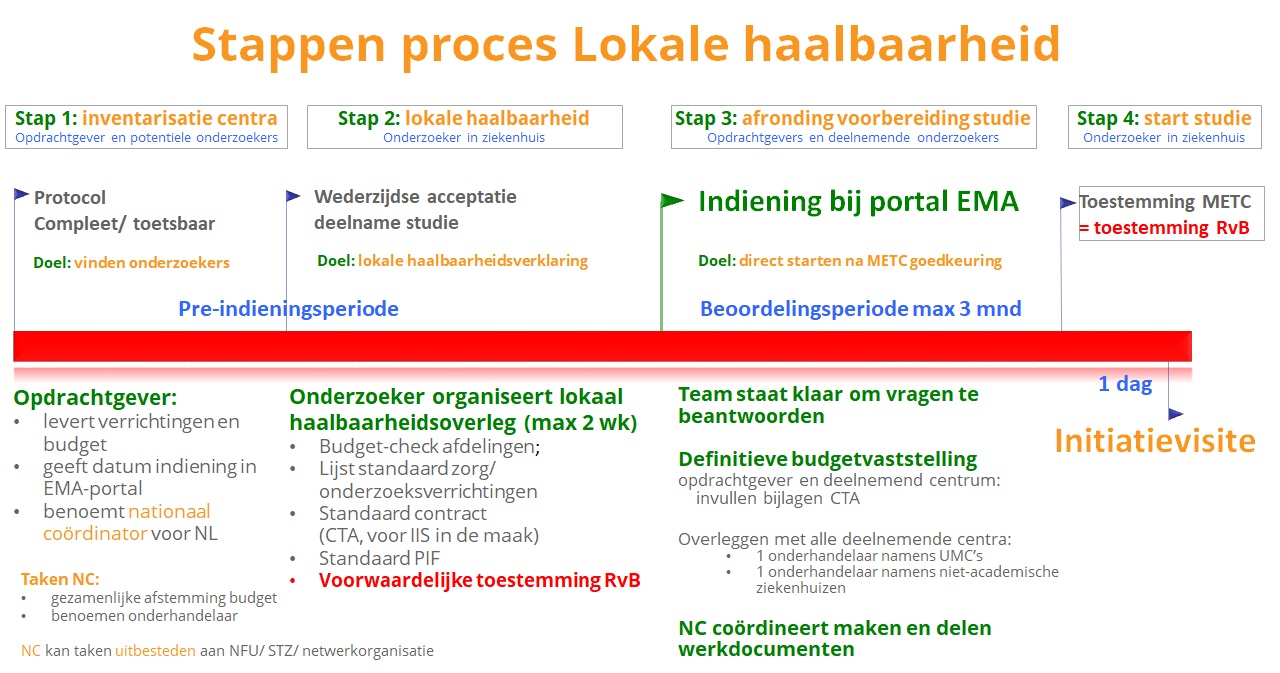
Definitieve versie van concept Procedure Lokale Haalbaarheid gepubliceerd
De DCRF Werkgroep Lokale Uitvoerbaarheid heeft op 25 september 2017 de definitieve versie van het concept van de Procedure Lokale Haalbaarheid bekend gemaakt.
Aanleiding voor de ontwikkeling van de Procedure Lokale Haalbaarheid is de komst van Verordening (EU) nr. 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik.
"Om Nederland aantrekkelijk te houden voor opdrachtgevers van klinisch geneesmiddelenonderzoek, is het noodzakelijk dat er in ziekenhuizen standaardisatie en harmonisatie komt van de lokale goedkeuringsprocedures voor de uitvoering van klinisch onderzoek, zodat de deelnemende centra de nodige informatie tijdig kunnen aanleveren voor indiening in het EU-portaal." (bron: pagina 1, DCRF Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek, versie definitief, dd 24 september 2017)
Een van de doelstellingen van de Procedure Lokale Uitvoerbaarheid is dat "het proces van opstarten van klinisch onderzoek met geneesmiddelen snel verloopt ..." zodat "Nederland ... concurrerend [is] ten opzichte van EU-landen, met het starten en uitvoeren van klinisch geneesmiddelenonderzoek" (bron: pagina 2, DCRF Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek, versie definitief, dd 24 september 2017).
In het kort, de definitieve concept Procedure Lokale Uitvoerbaarheid bestaat uit 4 stappen:
- Inventarisatie centra en benoemen Nationaal Coördinator;
- Regelen lokale haalbaarheid in de onderzoekscentra;
> o.a. haalbaarheidsoverleg, opstellen lokale haalbaarheidsverklaring en voorwaardelijke toestemming RvB. - Beoordeling onderzoek door METC en afronding voorbereiding studie;
- Initiatievisite en start inclusie proefpersonen.
Voor een grafische weergave van de procedure, klik op onderstaande afbeelding (of deze link)
Pilots over stap 1 en 2
"De werkgroep Lokale Uitvoerbaarheid heeft besloten om de procedure in twee delen in de praktijk te testen: een pilot over Stap 1 en een pilot over Stap 2." (bron: DCRF website 'Lokale Haalbaarheid')
Er zal eerst gestart worden met een pilot over stap 2 van de Procedure Lokale Uitvoerbaarheid. Van deze pilot wordt verwacht dat deze in januari 2018 van start zal gaan.
De pilot over stap 1 vergt echter meer voorbereiding. De DCRF verwacht dat er begin 2018 meer informatie beschikbaar is over de pilot over Stap 1.
Welk instellingen doen mee aan de pilot over stap 2?
Er hebben zich zestien instellingen aangemeld voor de pilot over stap 2. Een presentatie die gegeven is tijdens een Clinops overleg wekt de indruk dat de volgende instellingen gaan deelnemen aan de pilot over stap 2:
- Amphia ziekenhuis
- CTCM
- Elisabeth-TweeSteden Ziekenhuis
- Emotional Brain
- Jeroen Bosch Ziekenhuis
- LUMC
- Maasstad ziekenhuis
- Martini Ziekenhuis
- Medisch Spectrum Twente
- NKI/Antoni van Leeuwenhoek
- Noordwest ziekenhuisgroep
- Radboudumc
- Rijnstate
- Slingeland Ziekenhuis
- UMC Utrecht
- Zuyderland Medisch Centrum
Bron: Max, T. (23 september 2017). Update pilot LUH en ECTR - dia 3
Voor de geïntresseerden, de presentatie is te downloaden via het ACRON nieuwsbericht 'Inbreng aanwezigen ACRON symposium verwerkt in procedure Lokale Haalbaarheid' van 25 september 2017.
Meer informatie
Download
ACRON betrokken bij ontwikkeling EU portal voor klinische proeven met geneesmiddelen voor menselijk gebruik
Op 25 september 2017 liet de Associatie van Contract Research Organisaties in Nederland (ACRON) middels een nieuwsbericht weten dat Ingeborg Boddeke (GCP Central) genomineerd is voor deelname aan de zesde testronde van de EU portal. Deze zesde testronde staat gepland voor november 2017.
Eind september had duidelijk moeten zijn of Ingeborg Boddeke namens ACRON ook aan de zesde testronde mag deelnemen. Ook al nadert het einde van oktober, er is nog geen bericht verschenen over de uiteindelijke selectie van kandidaten voor de zesde testronde. Het is dus nog niet bekend of Ingeborg Boddeke ook daadwerkelijk mag deelnemen aan de zesde testronde van de EU portal.
Gereviseerde EMA 'External guidance on the implementation of the European Medicines Agency policy on the publication of clinical data for medicinal products for human use' gepubliceerd
Het European Medicines Agency (EMA) heeft op september 2017 een gereviseerde 'External guidance on the implementation of the European Medicines Agency policy on the publication of clinical data for medicinal products for human use' gepubliceerd.
|
Wright, E. & Sideri, E. (9 October 2017). EMA publishes external guidance for clinical data publication. Hogan Lovelss, Focus on Regulation [blog]. |
De doelmatigheid en transparantie van geneesmiddelenonderzoek
|
Van den Bogert, C.A. (2017). Trials & Tribulations : Studies on the fate, transparency and efficiency of clinical drug trials (Dissertation). Utrecht University. ISBN: 978-90-393-6844-2. |
|
CCMO nieuwsbericht (26 september 2017). Doelmatigheid en transparantie van klinisch geneesmiddelenonderzoek moet beter. |
|
Promotie Sander van den Bogert. Onvoldoende doelmatigheid en transparantie in klinisch geneesmiddelenonderzoek. Universiteit Utrecht, Agenda. |
Onderzoek met Medische Hulpmiddelen
IGJ rapport Cryoballonkatheter Erasmus MC gepubliceerd
De Inspectie Gezondheidszorg en Jeugd (IGJ) heeft op 11 oktober 2017 haar bevindingen gepubliceerd met betrekking tot een onderzoek van het Erasmus MC naar de veiligheid en werking van een cryoballonkatheter bij de behandeling van patiënten met boezemfibrilatie.
In een brief aan de Tweede Kamer geeft de minister van Volksgezondheid, Welzijn en Sport (VWS) een korte samenvatting van de conclusies:

(bron: Brief van de minister van VWS, d.d. 11 oktober 2017)
Via de website van de Tweede Kamer is het IGJ rapport, de brief van de minister van VWS en de reactie van het Erasmus MC te downloaden.
In de media
|
Skipr Redactie (12 oktober 2017). Niet meer na te gaan of Erasmus MC regels overtrad. |
|
Simone Paauw, S. (11 oktober 2017). Inspectie: ‘Onduidelijk of cryoballononderzoek deugde’. Medisch Contact. |
|
Rosenberg E. & Berkhout, K. (11 oktober 2017). Inspectie kritisch over Rotterdamse ballonstudie. NRC. |
21 november 2017 - EFGCP: Multi-Stakeholder Workshop on Facilitating Medicines Development for Youth and the ‘Young at Heart’: Learning for Intergenerational Strategies
Locatie: Londen (UK)
22 november 2017 - Medicines for Europe: 1st Value Added Medicines Conference – A new value proposition for patients, healthcare practitioners and systems
Locatie: Brussel (België)
5 december 2017 - EBE*: 6th EBE Annual Regulatory Conference “Realising the potential of advanced therapies for patients”
*EBE = European Biopharmaceutical Enterprises
Locatie: Londen (Verenigd Koninkrijk)
EMA: Reflection paper on the use of extrapolation in the development of medicines for paediatrics
Consultatie sluit 14 januari 2018
Meer bijeenkomsten en consultaties?
Voor meer bijeenkomsten en lopende publieke consultaties zie:
|
EMA Press release (20 October 2017). Unparalleled access to clinical data - one year on. |
|
ACRP news (19 October 2017). ACRP Advances CRC Competency-Based Standards. |
|
ALLEA Statement on Patentability of Inventions Involving Human “Embryonic” Pluripotent Stem Cells in Europe (October 2017), final version. |
|
Wageningen Universiteit Persbericht (19 oktober 2017). Methode om risico’s van toxische stoffen te beoordelen is aan herziening toe. |
|
Opstelten, W., Bindels, P.J.E. & Burgers, J.S. (19 oktober 2017). Onderzoek in de huisartsenpraktijk: daar wordt iedereen beter van. Ned Tijdschr Geneeskd. 2017;161:D1996 |
|
Kramer DB, Fu K. Cybersecurity Concerns and Medical Devices. Lessons From a Pacemaker Advisory. JAMA. Published online October 18, 2017. doi:10.1001/jama.2017.15692 |
|
Lyon J. Bioethics Panels Open Door Slightly to Germline Gene Editing. JAMA. Published online October 18, 2017. doi:10.1001/jama.2017.13962 |
|
Sykora, P. & Caplan, A. (6 October 2017). The Council of Europe should not reaffirm the ban on germline genome editing in humans. EMBO reports (2017) e201745246. DOI 10.15252/embr.201745246 |
|
EMA News (16 October 2017). EMA’s Business Continuity Plan for Brexit published. |
|
Mathes, Tim et al. Registry-based randomized controlled trials merged the strength of randomized controlled trails and observational studies and give rise to more pragmatic trials. Journal of Clinical Epidemiology (articles in press). |
|
Coppens, D.G.M., De Bruin, M.L., Leufkens, H.G.M. and Hoekman, J. (), Global regulatory differences for gene and cell based therapies: consequences and implications for patient access and therapeutic innovation. Clin. Pharmacol. Ther.. Accepted Author Manuscript. doi:10.1002/cpt.894 |
|
Barnard ND, Willett WC, Ding EL. The Misuse of Meta-analysis in Nutrition Research. JAMA. 2017;318(15):1435–1436. doi:10.1001/jama.2017.12083 |
|
Yadav K, Lewis RJ. Gatekeeping Strategies for Avoiding False-Positive Results in Clinical Trials With Many Comparisons. JAMA. 2017;318(14):1385–1386. doi:10.1001/jama.2017.13276 |
|
Valverde, S. & Williams, A. (13 October 2017). New European Guidelines on working with patient groups. BioSlice Blog, Arnold & Porter Kaye Scholer LLP. |
|
Maassen, H. (11 oktober 2017). Onderzoekers hadden overlijden comateuze patiënt moeten melden. Medisch Contact, Arts in Spe. |
|
Fassbender, M. (11 October 2017). China now accepting clinical trial data from other countries. Outsourcing-Pharma.com |
|
Haussen, D.C., et al., Utilization of a Smartphone Platform for Electronic Informed Consent in Acute Stroke Trials. Stroke. STROKEAHA.117.018380, originally published October 6, 2017 |
|
Van der Kuil, J. (10 oktober 2017). Wanneer zijn elektronische data een GMP registratie. Quality Business Support Blog. |
|
Jaklevic, M.C. (9 October 2017). ‘Ethical bordellos:’ Op-eds don’t always disclose Big Pharma conflicts of interest. Health News Review [blog]. |
|
Cato, M.E. & Allyson B. Mullen, A.B. (8 October 2017). FDA Finalizes Guidance on Evaluation and Reporting of Age-, Race-, and Ethnicity-Specific Data in Medical Device Clinical Studies. FDA Law Blog. |
|
Ziai H, Zhang R, Chan A, et al Search for unpublished data by systematic reviewers: an audit BMJ Open 2017;7:e017737. doi: 10.1136/bmjopen-2017-017737 |
|
Editorial (6 October 2017). Rationalizing combination therapies. Nature Medicine 23, 1113 (2017) doi:10.1038/nm.4426 |
|
Marston HD, Paules CI, Fauci AS. The Critical Role of Biomedical Research in Pandemic Preparedness. JAMA. Published online October 04, 2017. doi:10.1001/jama.2017.15033 |
|
Wright, E. & Sideri, E. (5 October 2017). European Commission adopted legal acts to improve Good Manufacturing Practices for medicinal products. Hogan Lovells, Focus on Regulation [blog]. |
|
Rijksoverheid Nieuwsbericht (6 oktober 2017). Start aanbesteding voor bouw van pand voor Europees Medicijnagentschap in Amsterdam. |
|
Mauri, L. & D’Agostino, R.B. (5 October 2017). Challenges in the Design and Interpretation of Noninferiority Trials. N Engl J Med 2017; 377:1357-1367 DOI: 10.1056/NEJMra1510063 |
|
Wagner, C.S. & Jonkers, K. (5 October 2017). Open countries have strong science. Nature 550, 32–33. doi:10.1038/550032a |
|
Tsang, L. & Strom, L. (5 October 2017). Update on transparency of clinical data. BioSlice Blog, Arnold & Porter Kaye Scholer LLP. |
|
Van Kempen, J. (4 oktober 2017). Patiëntenorganisatie lokt proces uit voor betaalbare medicijnen. Het Parool. |
|
EMA News (4 October 2017). Countdown to launch of new EudraVigilance System. |
|
Gibney, E. (3 October 2017). Ethics of Internet research trigger scrutiny. Nature 550, 16–17 (05 October 2017) doi:10.1038/550016a |
|
Schuster MA, Onorato SE, Meltzer DO. Measuring the Cost of Quality Measurement. A Missing Link in Quality Strategy. JAMA. 2017; 318(13):1219–1220. doi:10.1001/jama.2017.11525 |
|
Unguru, Y. Speed and Safety in Drug Approval and Commercialization. Pediatrics Oct 2017, e20170791; DOI: 10.1542/peds.2017-0791 |
|
Vereniging Innovatieve Geneesmiddelen nieuwsbericht (3 oktober 2017). Büller: ‘Schaf fase 3-onderzoek af’ |
|
Long, C.R., Stewart, M.K. & McElfish, P.A. (2 October 2017). Health research participants are not receiving research results: a collaborative solution is needed. Trials 2017 18:449 |
|
Mulryne, J. (2 October 2017). MHRA guidance on human factors for medical devices. BioSlice Blog, Arnold & Porter Kaye Scholer LLP. |
|
Brown, K.V. (29 September 2017). Should Scientists Be Posting Their Work Online Before Peer Review? Gizmodo. |
|
ARM, EBE, EFPIA and EuropaBio jointly publish a series of proposals to streamline requirements and accelerate approvals of clinical trials with new therapies that consist of or contain Genetically Modified Organisms (GMOs) in Europe (27 September 2017). |
|
Cynthia S Kubu, Paul J Ford (25 September 2017). Clinical Ethics in the Context of Deep Brain Stimulation for Movement Disorders, Archives of Clinical Neuropsychology |
|
Hurley, C., Sinnott, C., Clarke, M., Kearney, P., Racine, E., Eustace, J. & Shiely, F. (11 September 2017). Perceived barriers and facilitators to Risk Based Monitoring in academic-led clinical trials: a mixed methods study. Trials 2017 18:423 |
|
Pace Jessica, Ghinea Narcyz, Kerridge Ian, Lipworth Wendy. Demands for access to new therapies: are there alternatives to accelerated access? BMJ 2017; 359 :j4494 |
|
Davis Courtney, Naci Huseyin, Gurpinar Evrim, Poplavska Elita, Pinto Ashlyn, Aggarwal Ajay et al. Availability of evidence of benefits on overall survival and quality of life of cancer drugs approved by European Medicines Agency: retrospective cohort study of drug approvals 2009-13 BMJ 2017; 359 :j4530 |
|
Cohen Deborah. Cancer drugs: high price, uncertain value BMJ 2017; 359 :j4543 |
|
Godlee Fiona. What you need to know about cancer drugs BMJ 2017; 359 :j4585 |
|
Dear, R.F., et al. “Standard Care” in Cancer Clinical Trials: An Analysis of Care Provided to Women in the Control Arms of Breast Cancer Clinical Trials. J Natl Compr Canc Netw 2017;15:1131-1139. DOI: 10.6004/jnccn.2017.7012 |
|
Ellenberg, S. (26 September 2017). Randomized Clinical Trials Will be Needed for the Foreseeable Future. CRITical Thinking [blog]. |
|
EMA Press release (26 September 2017). Update on EMA relocation preparedness. |
|
Bartels DJP, van Laarhoven AIM, Stroo M, Hijne K, Peerdeman KJ, et al. (2017) Minimizing nocebo effects by conditioning with verbal suggestion: A randomized clinical trial in healthy humans. PLOS ONE 12(9): e0182959. |
|
Woloshin, S., Schwartz, L.M., White, B. & Moore, T.J. (21 September 2017). The Fate of FDA Postapproval Studies. N Engl J Med 2017; 377:1114-1117 DOI: 10.1056/NEJMp1705800 |
|
McKee, A. E., Markon, A. O., Chan-Tack, K. M. and Lurie, P. (2017), How Often Are Drugs Made Available Under the Food and Drug Administration's Expanded Access Process Approved?. The Journal of Clinical Pharmacology, 57: S136–S142. doi:10.1002/jcph.960 |
|
Lancee, M., Lemmens, C.M.C., Kahn, R.S., Vinkers, C.H. & Luykx, J.J. (12 September 2017). Outcome reporting bias in randomized-controlled trials investigating antipsychotic drugs. Translational Psychiatry (2017) 7, e1232; doi:10.1038/tp.2017.203 |
|
Zuidgeest, Mira G.P. et al. Series: Pragmatic trials and real world evidence: Paper 1. Introduction. Journal of Clinical Epidemiology , Volume 88 , 7 - 13 |
|
Kimmelman J, Carlisle B, Gönen M. Drug Development at the Portfolio Level Is Important for Policy, Care Decisions and Human Protections. JAMA. 2017;318(11):1003–1004. doi:10.1001/jama.2017.11502 |
|
Fox, L., Toms, C., Kernaghan, S., Snowdon, C. & Bliss, J.M. (26 September 2017). Conducting non-commercial international clinical trials: the ICR-CTSU experience. Trials 2017 18:440. |
|
Sawyer, A., Chhoa, C., Ayers, S., Pushpa-Rajah, A. & Duley, L. (9 September 2017). Women’s views and experiences of two alternative consent pathways for participation in a preterm intrapartum trial: a qualitative study. Trials 2017 18:422 |
|
van de Garde EMW, Plouvier BC, Fleuren HWHA, et al Pharmacotherapy within a learning healthcare system: rationale for the Dutch Santeon Farmadatabase Eur J Hosp Pharm Published Online First: 18 September 2017. doi: 10.1136/ejhpharm-2017-001329 |
|
Julien Tanniou, Steven Teerenstra, Sagal Hassan, Andre Elferink, Ingeborg van der Tweel, Christine Gispen-de Wied, Kit C.B. Roes, European regulatory use and impact of subgroup evaluation in marketing authorisation applications, In Drug Discovery Today, 2017, , ISSN 1359-6446 |
|
Mikk KA, Sleeper HA, Topol EJ. The Pathway to Patient Data Ownership and Better Health. JAMA. Published online September 25, 2017. doi:10.1001/jama.2017.12145 |
|
Batra S, Howick J. Empirical evidence against placebo controls. Journal of Medical Ethics 2017;43:707-713. |
|
Christopher PP, Appelbaum PS, Truong D, Albert K, Maranda L, et al. (2017). Reducing therapeutic misconception: A randomized intervention trial in hypothetical clinical trials. PLOS ONE 12(9): e0184224. |
|
OHRP & FDA (September 2017). Minutes of Institutional Review Board (IRB) Meetings. Guidance for Institutions and IRBs. |
|
Ferreira, W.F., Gertner, H. & Nigam, K.K. (4 October 2017). FDA and OHRP Finalize Joint Guidance on IRB Meeting Minutes. Hogan Lovells, Focus on Regulation [blog]. |
|
Kerr-Peterson, H. & Mulryne, J. (8 September 2017). MHRA’s guide to the new EU Medical Devices Regulations. BioSlice Blog, Arnold & Porter Kaye Scholer LLP. |
|
Parker, R.A., Weir, C.J., Maxwell, A.E. & Al-Shahi Salman, R. (1 March 2017). Promoting Recruitment using Information Management Efficiently (PRIME): statistical analysis plan for a stepped wedge cluster randomised trial within the REstart or STop Antithrombotics Randomised Trial (RESTART). Trials 2017 18:94. |
Stuur de nieuwsbrief door naar uw collega's
Is de nieuwsbrief ook interessant voor uw collega's en contacten?
Bent u al abonnee?
Abonneer u vandaag nog op de ‘Nieuwsbrief voor Goede Onderzoekspraktijken’ (vrij van kosten, gratis!) en blijf op de hoogte van actuele ontwikkelingen rond medisch-wetenschappelijk onderzoek met mensen, nieuwe wet- en regelgeving en gereviseerde richtlijnen.
Klik hier om u aan te melden voor de Nieuwsbrief voor Goede Onderzoekspraktijken
Copyright © Vincent Bontrop, All rights reserved.
Contactgegevens:
Hopakker - 3514 BZ Utrecht - Netherlands
 |
 |