|
||||
Beste lezer,
Hierbij ontvangt u de Nieuwsbrief voor Goede Onderzoekspraktijken van 14 mei 2017, met de laatste ontwikkelingen rond medisch-wetenschappelijk onderzoek met mensen, nieuwe wet- en regelgeving en gereviseerde richtlijnen.
Heeft u een vraag of een verzoek? Of heeft u een nieuwstip? U kunt mij een bericht sturen door te antwoorden op deze e-mail of via het contactformulier op de website.
Met vriendelijke groet,
Inhoudsopgave
- WHO ICTRP trials registration dataset met twee elementen uitgebreid
- Vertraging bij ontwikkeling EU-portal voor klinische proeven
- EMA publiceert Annual Report 2016
- EU Verordening medische hulpmiddelen voor in-vitrodiagnostiek: Hoofdstuk VI en Bijlagen XIII en XIV nu ook als losse download beschikaar
- Publieke consultaties
- Uitgelicht
Medisch Wetenschappelijk Onderzoek
WHO ICTRP trials registration dataset met twee elementen uitgebreid
De World Health Organization (WHO) heeft bekend gemaakt dat tijdens de ICTRP Registry Network Meeting, die van 3 tot en met 4 mei 2017 heeft plaatsgevonden in Genève, is besloten om de ICTRP trials registration dataset met twee elementen uit te breiden:
"At the meeting, it was agreed to add the following to the core data elements collected by ICTRP from registries: details of the ethics committee approving each clinical trial, study completion date and results availability." (bron: WHO 'ICTRP Registry Network meeting 3-4 May 2017', z.d.)
Meer informatie over ICTRP
Deel de nieuwsbrief met uw collega's
Is de Nieuwsbrief voor Goede Onderzoekspraktijken ook interessant voor uw collega's en netwerkcontacten? Klik hier om de nieuwsbrief door te sturen
Onderzoek met Geneesmiddelen
Vertraging bij ontwikkeling EU-portal voor klinische proeven
De Centrale Commissie Mensgebonden Onderzoek (CCMO) maakte op 11 mei 2017 bekend dat er vertraging is opgelopen bij de ontwikkeling van de EU-portal.
"Nadere duiding en besluitvorming over de mogelijke gevolgen vindt plaats bij de vergadering van het EMA Management Board op 14 en 15 juni 2017." (bron: CCMO nieuwsbericht, d.d. 11 mei 2017)
EMA publiceert Annual Report 2016
Het European Medicines Agency’s (EMA) heeft op 10 mei 2017 haar jaarverslag over 2016 gepubliceerd, waarin onder andere wordt gerapporteerd over de uitgevoerde inspecties.
Good Manufacturing Practice
In 2016 zijn er 672 GMP inspecties uitgevoerd.
"The number of GMP inspections requests increased by 18.5% in 2016, linked to the growing number of centrally authorised products." (bron: EMA Annual Report 2016, pagina 72)
"In 2016, approximately 1% of the inspections conducted led to the issue of a non-compliance statement (24 out of 2,293)." (bron: EMA Annual Report 2016, pagina 73)
Good Clinical Practice
Er zijn 121 GCP inspecties uitgevoerd.
"In 2016,the largest number of GCP inspections requested by the CHMP were conducted in the EU/EEA, followed by the USA and the Middle East/Asia/Pacific regions which have the highest number of patients, investigator sites and pivotal clinical trials included in MAAs for centrally authorised products." (bron: EMA Annual Report 2016, pagina 74)
"In 2016, the majority of findings were reported in the EU/ EEA region and the most common grading was major." (bron: EMA Annual Report 2016, pagina 74)
De GCP inspecties die binnen de EU/EER zijn uitgevoerd leverde 153 minor, 219 major en 49 critical bevindingen op.
Onderzoek met Medisch Hulpmiddelen voor In-Vitrodiagnostiek
EU Verordening medische hulpmiddelen voor in-vitrodiagnostiek: Hoofdstuk VI en Bijlagen XIII en XIV nu ook als losse download beschikaar
De EU verordeningen betreffende medische hulpmiddelen en medische hulpmiddelen voor in-vitrodiagnostiek zijn op 5 mei 2017 gepubliceerd in het Publicatieblad van de Europese Unie (PB L 117, 5 mei 2017).
Zoals was te lezen in Nieuwsbrief voor Goede Onderzoekspraktijken nr. 31 van 8 Mei 2017, heb ik omwille van het gemak en de leesbaarheid 'losse' pdf-bestanden gemaakt van hoofdstuk VI (klinische evaluatie en klinische onderzoeken) en bijlage XV (klinisch onderzoek), van Verordening (EU) 2017/745 betreffende medische hulpmiddelen.
Inmiddels heb ik, voor de liefhebber, hetzelfde gedaan met Verordening (EU) 2017/746 betreffende medische hulpmiddelen voor in-vitrodiagnostiek. De onderdelen uit de verordening voor medische hulpmiddelen voor in-vitrodiagnostiek die betrekking hebben op klinisch onderzoek zijn met behulp van onderstaande links te downloaden.
Download
OECD: Draft Guidance Documents on Good Laboratory Practice (GLP)
Consultatie open tot 22 juni 2017
USP: General Chapter Compounding for Phase I Investigational Studies
Consultatie open tot 31 juli 2017
Meer bijeenkomsten en consultaties?
Voor meer bijeenkomsten en lopende publieke consultaties zie ook:
- Overzicht bijeenkomsten & consultaties - mei 2017
- Nieuwsbrief voor Goede Onderzoekspraktijken nr. 31 (8 Mei 2017)
Wilt u ook eenmaal per maand een overzicht ontvangen van alle bij mij bekende bijeenkomsten en publieke consultaties? Klik hier om uw voorkeuren aan te passen
|
Benjamin, R.S. (12 May 2017). Observational studies: goldmines of information on rare diseases. BMC Medicine 2017 15:100. DOI: 10.1186/s12916-017-0868-7 |
|
Editorial. Prepublication and clinical practice: challenges ahead. The Lancet Neurology , Volume 16 , Issue 6 , 409. |
|
Fellows, M. (12 May 2017). China threatens prison time and death penalty to fight fraudulent trial data. Pharmafile. |
|
Cyranoski, D. (11 May 2017). China cracks down on fake data in drug trials. Nature doi:10.1038/nature.2017.21977 |
|
Clemence, B., Walkinshaw, Z., Mulryne, J. & Dickinson, R. (12 May 2017). WP29 Reviews the European Draft Code of Conduct on Privacy for Mobile Health Apps. Digital Health Download, Arnold & Porter Kaye Scholer. |
|
Turley, A. (11 May 2017). OECD aims to extend acceptance of non-animal test data. ChemicalWatch. |
|
Allotey P, Allotey-Reidpath C, Reidpath DD (2017) Gender bias in clinical case reports: A cross-sectional study of the “big five” medical journals. PLOS ONE 12(5): e0177386. |
|
ECA Academy (11 mei 2017). New USP Draft Chapter Compounding for Phase I Investigational Studies. |
|
Han, A.P. (11 May 2017). “Dramatic impact:” Authors misread breast cancer treatment database, retract paper. Retraction Watch. |
|
Hartley, J. & Cabanac, G. (10 May 2017). Why has submitting a manuscript to a journal become so difficult? A call to simplify an overly complicated process. LSE Impact Blog, The London School of Economics and Political Science. |
|
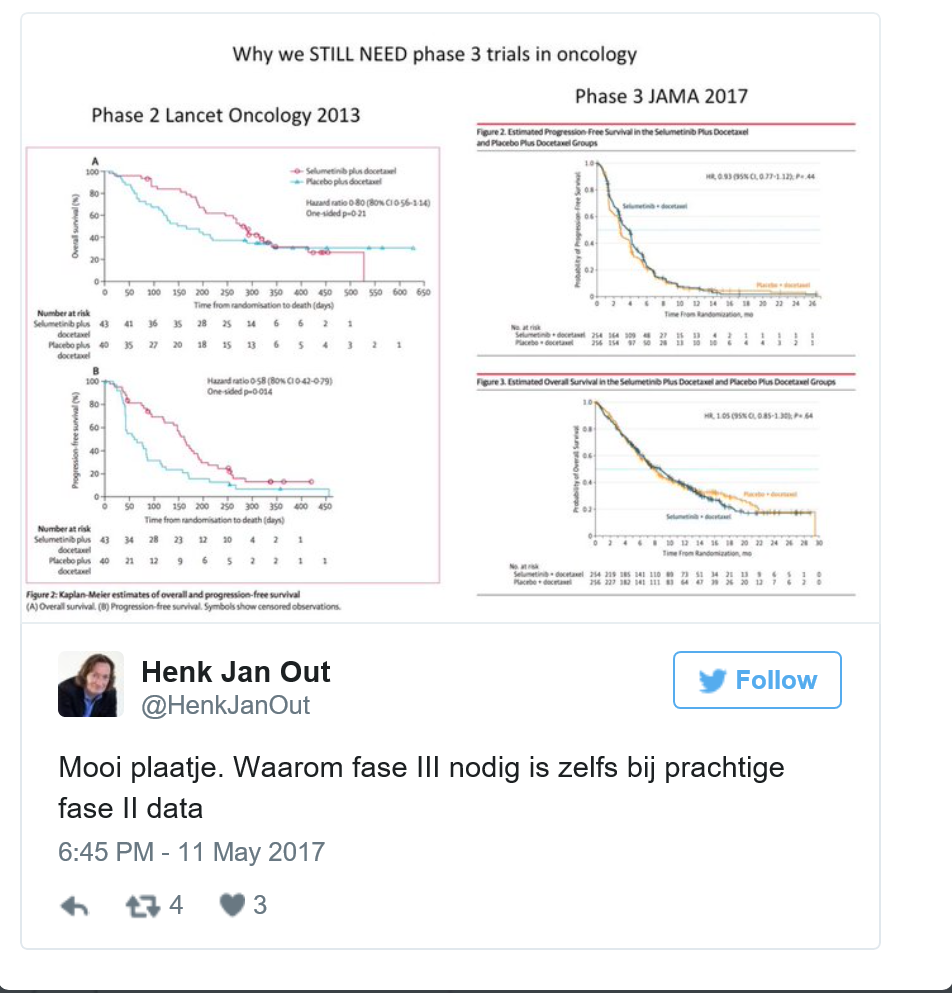
Why we STILL NEED phase 3 trials in oncology Fase II: Jänne, Pasi A et al. (2013). Selumetinib plus docetaxel for KRAS-mutant advanced non-small-cell lung cancer: a randomised, multicentre, placebo-controlled, phase 2 study. The Lancet Oncology , Volume 14 , Issue 1 , 38 - 47. Fase III: Jänne PA, van den Heuvel MM, Barlesi F, Cobo M, Mazieres J, Crinò L, Orlov S, Blackhall F, Wolf J, Garrido P, Poltoratskiy A, Mariani G, Ghiorghiu D, Kilgour E, Smith P, Kohlmann A, Carlile DJ, Lawrence D, Bowen K, Vansteenkiste J. Selumetinib Plus Docetaxel Compared With Docetaxel Alone and Progression-Free Survival in Patients With KRAS-Mutant Advanced Non–Small Cell Lung Cancer. The SELECT-1 Randomized Clinical Trial. JAMA. 2017;317(18):1844-1853. doi:10.1001/jama.2017.3438 |
|
Brief van de Staatssecretaris VWS (9 mei 2017). Essays over de morele aanvaardbaarheid van het kweken van menselijke organen in dieren. |
|
Jochemsen, H., Dondorp, W. & De Wert, G. Menselijke organen kweken in dieren: een ethische discussie. Essays i.o.v. Ministerie Volksgezondheid, Welzijn & Sport. Den Haag: VWS, 2017. |
|
Chen, T. (9 May 2017). 2016 MHRA GMP Inspections yields 50% more deficiencies in key areas. FDAzilla, blog. |
|
Hakala, A. K., Fergusson, D. and Kimmelman, J. (9 May 2017), Nonpublication of Trial Results for New Neurological Drugs: A Systematic Review. Ann Neurol. doi:10.1002/ana.24952 |
|
Downing NS, Shah ND, Aminawung JA, Pease AM, Zeitoun J, Krumholz HM, Ross JS. (9 May 2017). Postmarket Safety Events Among Novel Therapeutics Approved by the US Food and Drug Administration Between 2001 and 2010. JAMA. 2017;317(18):1854-1863. doi:10.1001/jama.2017.5150 |
|
Gelman, A. (9 May 2017). Honesty and transparency are not enough. Statistical Modeling, Causal Inference, and Social Science, blog. |
|
Huang, E. (8 May 2017). China publishes more science research with fabricated peer-review than everyone else put together. Quartz. |
|
Grens, K. (8 May 2017). Preclinical Studies Don't Regularly Adhere to Best Practices. The Scientist. |
|
EMA press release (8 May 2017). Involving patients in discussions on benefits and risks of medicines. |
|
Yuko, E. (8 May 2017). Weighing the Ethics of Artificial Wombs. The NY Times. |
|
Neuroskeptic (8 May 2017). Neuropeptides and Peer Review Failure. Discover, blogs. |
|
Hao Cheng, Aditya Chawla, Yafeng Yang, Yuxiao Li, Jin Zhang, Hae Lin Jang, Ali Khademhosseini, Development of nanomaterials for bone-targeted drug delivery, Drug Discovery Today, Available online 6 May 2017, ISSN 1359-6446. |
|
Opinie (6 mei 2017). Zeggenschap over ons DNA-materiaal belangrijk om bij wet te regelen. Trouw. |
|
Azvolinsky, A. (5 May 2017). Stem Cell Trial Data Mostly Go Unpublished. The Scientist. |
|
Chakradhar, S. (5 May 2017). Bringing RNA into the fold: Small molecules find new targets in RNA to combat disease. Nature Medicine 23, 532–534 (2017) doi:10.1038/nm0517-532 |
|
NRC (4 mei 2017). Onderzoekers in de psychiatrie begrijpen elkaar niet eens. |
|
Editorial (4 May 2017). Integrity starts with the health of research groups. Nature 545, 5–6 doi:10.1038/545005b |
|
Tregoning, J. (4 May 2017). No researcher is too junior to fix science. Nature 545, 7 doi:10.1038/545007a |
|
Robertson, M. (3 May 2017). The scientific Odyssey: Pre-registering the voyage. BioMed Central, blog network. |
|
Filipe A, Renedo A, Marston C (3 May 2017) The co-production of what? Knowledge, values, and social relations in health care. PLOS Biology 15(5): e2001403. |
|
Ioannidis JPA. Defending Biomedical Science in an Era of Threatened Funding. JAMA. Published online May 01, 2017. doi:10.1001/jama.2017.5811 |
|
Drug Discovery Today, Volume 22, Issue 5, Pages 751-834 (May 2017) |
|
Bradley J. Erickson, Panagiotis Korfiatis, Zeynettin Akkus, and Timothy L. Kline. Machine Learning for Medical Imaging. RadioGraphics 2017 37:2, 505-515 |
|
Henson, E. (26 April 2017). Things you should never say during a regulatory inspection. Eldon's Porch, blog. |
|
Markin, P. (25 April 2017). The Sustainability of Open Access Publishing Models Past a Tipping Point. Open Science, blog. |
|
Vasilevsky NA, Minnier J, Haendel MA, Champieux RE. (2017) Reproducible and reusable research: are journal data sharing policies meeting the mark? PeerJ 5:e3208 |
|
Ward, R.M. et al. (1 March 2017). Safety, dosing, and pharmaceutical quality for studies that evaluate medicinal products (including biological products) in neonates. Pediatric Research (2017) 81, 692–711 doi:10.1038/pr.2016.221 |
|
Sanders, S.L., Rathbone, J., Bell, K.J.L. et al. Systematic review of the effects of care provided with and without diagnostic clinical prediction rules. Diagn Progn Res (2017) 1: 13. doi:10.1186/s41512-017-0013-2 |
|
Whyte, J.J. (19 April 2017). An FDA Perspective On Patient Diversity In Clinical Trials. Clinical Leader. |
|
Wilkinson, J. (12 April 2017). 6 Common Flaws To Look Out For in Peer Review. Publons. |
|
Taljaard, M., et al. (8 April 2017). Inadequacy of ethical conduct and reporting of stepped wedge cluster randomized trials: Results from a systematic review. Clinical Trials. |
|
Hartley, J. and Cabanac, G. (2017), The delights, discomforts, and downright furies of the manuscript submission process. Learned Publishing, 30: 167–172. doi:10.1002/leap.1092 |
Copyright © Vincent Bontrop, All rights reserved.
Contactgegevens:
Hopakker - 3514 BZ Utrecht - Netherlands
 |
 |