| Bekijk deze e-mail in je browser |
Beste lezer,
Hierbij ontvangt u de Nieuwsbrief voor Goede Onderzoekspraktijken van 23 april 2017, met de laatste ontwikkelingen rond medisch-wetenschappelijk onderzoek met mensen, nieuwe wet- en regelgeving en gereviseerde richtlijnen.
Voor vragen, verzoeken en nieuwstips kunt u mij bereiken door te antwoorden op deze e-mail of via het contactformulier op de website.
Met vriendelijke groet,
Inhoudsopgave
- DCRF maakt nieuwe werkwijze omtrent toegang tot EPD bekend
- Van Gerven per 15 juni 2017 voorzitter CCMO
- Wettelijke regeling voor gunstbetoon bij medische hulpmiddelen en enkele bepalingen over transparantie tussen beroepsbeoefenaren en bedrijven op het terrein van geneesmiddelen en medische hulpmiddelen
- WHO: The Global Observatory on Health R&D: the Observatory
- DCRF en CCMO zijn gestart met ECTR bijeenkomsten
- Nederland stelt zich formeel kandidaat voor vestiging van het European Medicines Agency (EMA)
- Wijziging Wkkgz in verband met instellen implantatenregister
- SCDM Good Clinical Data Management Practices (GCDMP©) reeds sinds 19 oktober 2016 gratis beschikbaar
- Bijeenkomsten
- Publieke consultaties
- Uitgelicht
Medisch Wetenschappelijk Onderzoek
DCRF maakt nieuwe werkwijze omtrent toegang tot EPD bekend
De Dutch Clinical Research Foundation heeft op 21 april 2017 bekend gemaakt dat haar werkgroep EPD in samenwerking met de Autoriteit Persoonsgegevens een template opdrachtbrief hebben opgesteld waarmee monitors toegang kunnen verkrijgen tot de patientdossiers van de deelnemende proefpersonen.
Bij de DCRF template opdrachtbrief hoort ook een nieuwe werkwijze die nader wordt toegelicht op de webpagina van de DCRF werkgroep EPD. Ook heeft de werkgroep EPD een stappenplan voor instellingen opgesteld voor het verlenen van toegang tot het EPD ten behoeve van het monitoren.
De afspraken rond het verlenen van toegang tot het EPD zullen worden meegenomen met de volgende update van de DCRF modelovereenkomst. De bijgewerkte versie van de modelovereenkomst wordt over een half jaar verwacht.
Bron/Ga naar 'themapagina werkgroep EPD'
Download DCRF template opdrachtbrief
Download DCRF stappenplan toegang monitoren tot EPD
* op de webpagina van de werkgroep EPD wordt verwezen naar een artikel op de website van het eClinical Forum. De link verwijst echter naar de website en helaas niet naar het bewuste artikel. Ik heb daarom de moeite genomen het artikel op te zoeken. Hieronder vindt u de directe link naar het artikel:
Van Gerven per 15 juni 2017 voorzitter CCMO
De Centrale Commissie Mensgebonden Onderzoek (CCMO) heeft op 20 april 2017 bekend gemaakt dat prof. dr. J.M.A. van Gerven per 15 juni 2017 zal worden benoemd als voorzitter van de CCMO voor een periode van vier jaar.
Wettelijke regeling voor gunstbetoon bij medische hulpmiddelen en enkele bepalingen over transparantie tussen beroepsbeoefenaren en bedrijven op het terrein van geneesmiddelen en medische hulpmiddelen
De Tweede Kamer heeft op 18 april 2017 het voorstel tot "[w]ijziging van wetgeving in verband met het invoeren van een wettelijke regeling voor gunstbetoon bij medische hulpmiddelen en enkele bepalingen over transparantie tussen beroepsbeoefenaren en bedrijven op het terrein van geneesmiddelen en medische hulpmiddelen" aangenomen.
De procedurevergadering van de Eerste Kamercommissie voor Volksgezondheid, Welzijn en Sport (VWS) zal op 9 mei 2017 plaatsvinden.
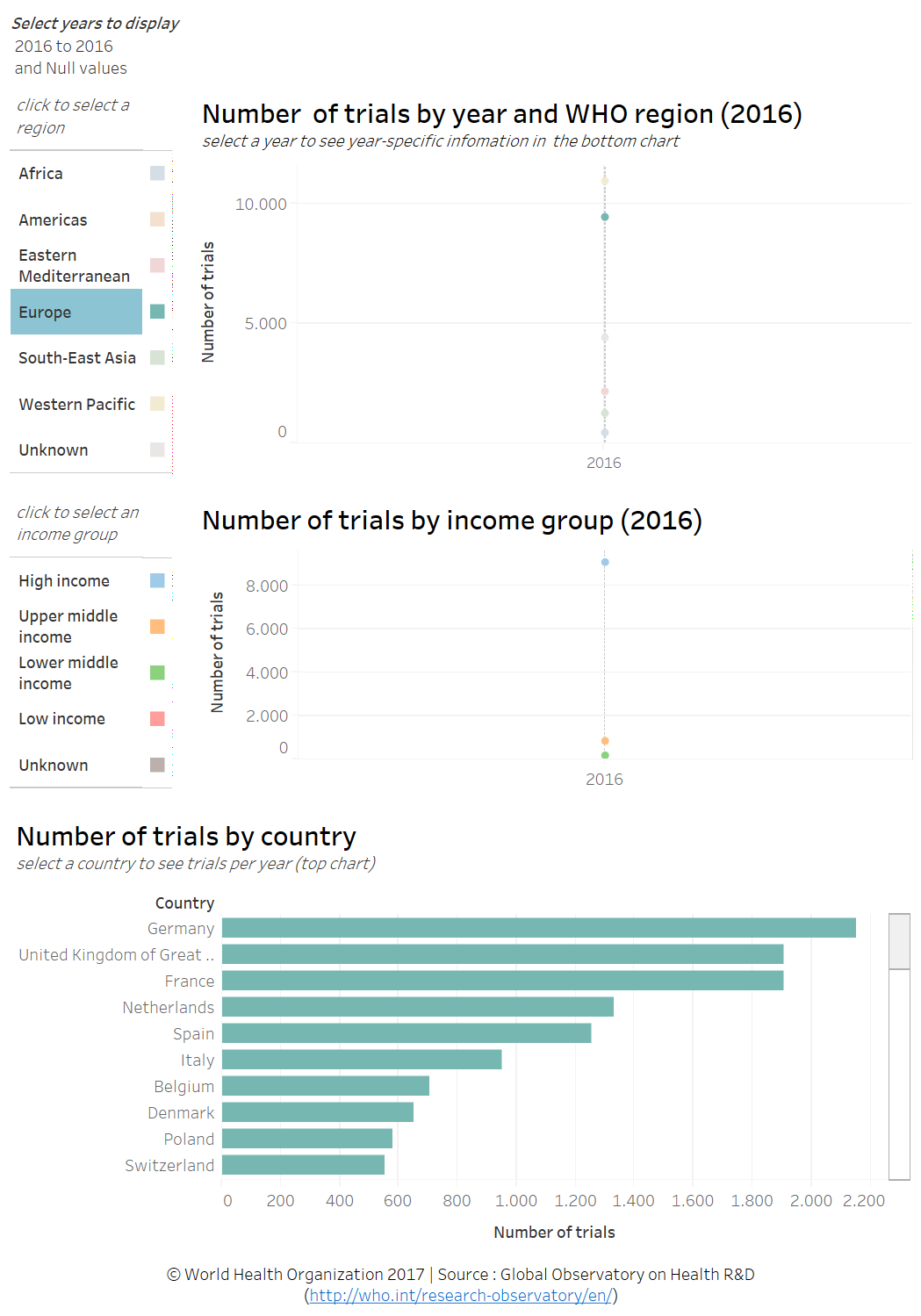
WHO: The Global Observatory on Health R&D: the Observatory
Afgelopen week kwam mij "The Global Observatory on Health R&D: the Observatory" van de World Health Organization onder de aandacht. Kort gezegd, het Observatory is een initiatief bedoeld om R&D prioriteiten te identificeren op basis van 'public health needs'.
Mede met behulp van informatie zoals die uit het WHO International Clinical Trials Registry Platform (ICTRP) maakt het Observatory ontwikkelingen en prestaties inzichtelijk zoals het aantal geregistreerde klinische onderzoeken dat binnen een werelddeel of land wordt uitgevoerd. Daarnaast is het mogelijk om werelddelen en landen met elkaar te vergelijken, zoals weergegeven in de afbeelding hierboven.
DCRF en CCMO zijn gestart met ECTR bijeenkomsten
Op 11 april 2017 heeft in het UMC Groningen de eerste informatiebijeenkomst over de ECTR plaatsgevonden. De DCRF en CCMO zullen ook de overige UMC's bezoeken. In mei zullen ze het Leids Universiteir Medisch Centrum bezoeken en in juni volgt er een bijeenkomst in het UMC Utrecht.
Nederland stelt zich formeel kandidaat voor vestiging van het European Medicines Agency (EMA)
Op 20 april 2017 heeft Nederland zich middels een brief aan de voorzitters van de Europese Raad en de Europese Commissie formeel kandidaat gesteld voor de vestiging van het European Medicines Agency (EMA). In de brief wordt Amsterdam voorgesteld als vestigingsplaats van het EMA.
"With its outstanding international travel connections and excellent working and living conditions, the Amsterdam metropolitan area meets all the requirements of the Agency and its staff. As one of the most active national regulatory agencies in the EU, the Dutch Medicines Evaluation Board is fully prepared to support the work of the EMA as a strong and independent regulator, safeguarding the proper functioning of the EU pharmaceutical system." (bron: brief regering aan de voorzitters van de Europese Raad en de Europese Commissie)
Volgens de berichtgeving zijn naast Nederland ook België, Denemarken, Frankrijk, Ierland, Italië, Malta, Polen, Spanje en Zweden kandidaat om het EMA te huisvesten (Hirschler, 2017; NOS 2017).
Denemarken, serieuze kanshebber
In haar poging het EMA naar Kopenhagen te halen heeft Denemarken een 'special envoy' aangesteld (Lars Rebien Sørensen), een speciale website opgezet en een brochure opgesteld.
De website en de brochure is te vinden via onderstaande link:
Dat er vanuit Denemarken flink wordt gelobbyd blijkt wel uit de brief van vertegenwoordigers van Deense publieke en private instellingen aan President Juncker, President Tusk en President Tajani.
Nederland op achterstand?
Denemarken maakt serieus werk van het EMA en mijn gevoel zegt dat Nederland, zeker ten opzichte van Denemarken, op enige achterstand staat. Wil Nederland het EMA naar Amsterdam halen dan is er naar mijn mening meer nodig dan alleen een brief van onze regering. Ik ben daarom zeer benieuwd of de Nederlandse publieke en privaate stakeholders het Deense voorbeeld zullen volgen en ook een brief aan de voorzitters van de Europese Raad en de Europese Commissie zullen sturen.
Kortom, wordt vervolgd!
Onderzoek met Medisch Hulpmiddelen
Wijziging Wkkgz in verband met instellen implantatenregister
De Tweede Kamer heeft op 18 april 2017 het voorstel tot "[w]ijziging van de Wet kwaliteit, klachten en geschillen zorg in verband met de totstandkoming van het implantatenregister ter bescherming van de gezondheid van cliënten" aangenomen.
Op 9 mei 2017 vindt de procedurevergadering plaats van de Eerste Kamercommissie voor Volksgezondheid, Welzijn en Sport (VWS).
"Het wetsvoorstel verplicht zorgaanbieders tot het registeren van een aantal specifieke gegevens om implantaten en cliënten aan wie implantaten zijn verstrekt te kunnen traceren en cliënten vervolgens te informeren indien er gezondheidsrisico’s blijken te zijn. De gegevens die betrekking hebben op bij cliënten ingebrachte implantaten worden door zorgaanbieders verstrekt ten behoeve van het implantatenregister." (bron: website Eerste Kamer, Wijziging van de Wet kwaliteit, klachten en geschillen zorg in verband met de totstandkoming van het implantatenregister ter bescherming van de gezondheid van cliënten (34 483))
Good Clinical Data Management Practice
SCDM Good Clinical Data Management Practices (GCDMP©) reeds sinds 19 oktober 2016 gratis beschikbaar
Afgelopen week was ik op de NVFG ClinOpsDag en na afloop merkte een van de aanwezigen op dat het onderwerp 'Clinical Data Management' wel wat meer onder de aandacht mag worden gebracht bij volgende edities van de ClinOpsDag. Ik besefte dat er in de nieuwsbrief ook weinig aandacht is voor het onderwerp en ben vervolgens gaan zoeken.
Het blijkt dat de Society for Clinical Data Management (SCDM) op 19 oktober 2016 haar Good Clinical Data Management Practices (GCDMP©) gratis beschikbaar heeft gesteld.
"As a reminder, perhaps the most exciting news of 2016 is that GCDMP© is now available for free. There has been huge support from our industry and the regulators in making this available to everyone." (Bron: SCDM Updates from the Board, 16 January 2017)
Om de GCDMP© te kunnen downloaden moeten er helaas wel eerst een aantal gegevens worden ingevuld (incl. emailadres).
Download SCDM Good Clinical Data Management Practices (GCDMP©)
7 juni 2017 - CBG Collegadag 2017
Locatie: Jaarbeurs, Utrecht
22 juni 2017 - NVFG Lustrum Congres
Locatie: Rotterdam
22 juni 2017 - Medisch Contact Live: De dokter en ethiek. Over alledaagse artsendilemma's
Locatie: 't Spant, Bussum
22 september 2017 - DARQA: Reference Safety information (RSI) in relatie tot GCP
Locatie: nog niet bekend
Er zijn geen nieuwe consultaties bekend.
Wilt u eenmaal per maand een overzicht ontvangen van consultaties en bijeenkomsten die bij mij bekend zijn? Klik hier om uw voorkeuren aan te passen. Het eerstvolgende overzicht zal op 1 mei 2017 worden verstuurd.
Bent u nog geen abonnee van de gratis Nieuwsbrief voor Goede Onderzoekspraktijken? Klik hier om naar de aanmeldpagina te gaan en word vandaag nog abonnee! U kunt bij uw aanmelding gelijk aangeven welke e-mail notificatieberichten u wilt ontvangen.
|
Baker, S. (23 April 2017). Biggest winners in knowledge transfer funding revealed. Times Higher Education. |
|
Staatssecretaris van Volksgezondheid, Welzijn en Sport (21 april 2017). Europese consultatie kindergeneesmiddelen. [reactie Nederlandse autoriteiten] |
|
Birse, M. (21 April 2017). 2016 GMP inspection deficiency data trend. MHRA Inspectorate blog. |
|
Kelland, K. (21 April 2017). Exclusive: Clash of science and politics 'dangerous' - EU food safety chief. Reuters. |
|
Maggie De Block Persbericht (21 april 2017). Klinische proeven als opportuniteit voor patiënt. |
|
Pharma.be persbericht (21 april 2017). Klinische studies: nieuwe wet om België in de Europese kopgroep te houden. |
|
McCook, A. (21 April 2017). Dear journals: Clean up your act. Regards, Concerned Biostatistician. Retraction Watch. |
|
Naeem, B. (20 April 2017). Computer System Validation - GCP. MHRA Inspectorate blog. |
|
Pharma.be (20 April 2017). The pharmaceutical industry in Belgium continues to grow. Invest In Flanders. |
|
World Health Organization. The Global Observatory on Health R&D: the Observatory. |
|
Beaver, J.A., Ison, G. & Pazdur, R. (20 April 2017). Reevaluating Eligibility Criteria — Balancing Patient Protection and Participation in Oncology Trials. N Engl J Med 2017; 376:1504-1505 DOI: 10.1056/NEJMp1615879 |
|
Medical Research Council (20 April 2017). MRC scientists discover two repurposed drugs that arrest neurodegeneration in mice. |
|
Jurajda, Š., Kozubek, S., Münich, D. et al. (2017). Scientific publication performance in post-communist countries: still lagging far behind. Scientometrics. doi: 10.1007/s11192-017-2389-8 |
|
Allum N, Allansdottir A, Gaskell G, Hampel J, Jackson J, et al. (2017). Religion and the public ethics of stem-cell research: Attitudes in Europe, Canada and the United States. PLOS ONE 12(4): e0176274. |
|
Stern, V. (19 April 2017). “Think of the unthinkable:” JAMA retraction prompts author to urge others to share data. Retraction Watch. |
|
EMA & FDA (19 April 2017). Report from the EMA-FDA QbD pilot program (EMA/213746/2017). |
|
Molema, F. (19 april 2017). Knippen en plakken in embryo-dna, moeten we dat toestaan? Nationale Zorggids |
|
IGZ Nieuwsbericht (18 april 2017). Verzoek IGZ aan handelsvergunninghouders: vragenlijst voor geneesmiddelenbewaking. |
|
European Medicines Agency (18 April 2017). Information security when using the EudraVigilance system. Best practice guide for management of authorised access to EudraVigilance (EMA/216598/2017) |
|
Stern, V. (18 April 2017). Fraud by bone researcher takes down two meta-analyses, a clinical trial, and review. Retraction Watch. |
|
Balasegaram M, Kolb P, McKew J, Menon J, Olliaro P, et al. (2017) An open source pharma roadmap. PLOS Medicine 14(4): e1002276. |
|
Wright, E. & Chaita, M. (18 April 2017). EMA seeks to support the use of patient registries and to improve dialogue between various stakeholders. Hogan Lovells, Focus on Regulation. |
|
Center for Science in the Public Interest (18 April 2017). PubMed to Include Conflict-of-Interest Statements with Study Abstracts. |
|
Giofrè D, Cumming G, Fresc L, Boedker I, Tressoldi P (2017) The influence of journal submission guidelines on authors' reporting of statistics and use of open research practices. PLOS ONE 12(4): e0175583. |
|
Montazerhodjat V, Chaudhuri SE, Sargent DJ, Lo AW. Use of Bayesian Decision Analysis to Minimize Harm in Patient-Centered Randomized Clinical Trials in Oncology. JAMA Oncol. Published online April 13, 2017. doi:10.1001/jamaoncol.2017.0123 |
|
Wang, Justin et al. (13 April 2017). Retraction of Neurosurgical Publications: A Systematic Review. World Neurosurgery, DOI: http://dx.doi.org/10.1016/j.wneu.2017.04.014 |
|
EMA (12 April 2017). Work instructions for inspection of quality control facilities located in third countries, adopted (updated). |
|
EMA (11 April 2017). European medicines agency Standard operating procedure (SOP): Standard operating procedure for notifications from marketing authorisation holders on pharmacovigilance non-compliance issues. |
|
The Research Ethics Application Database (TREAD). Hosted jointly by The Global Health Network and the Social Research Association. |
|
Vischer, N., Pfeiffer, C., Kealy, J. & Burri, C. (7 April 2017). Increasing protocol suitability for clinical trials in sub-Saharan Africa: a mixed methods study. Global Health Research and Policy 2017 2:11, DOI: 10.1186/s41256-017-0031-1 |
|
Commissie Genetische Modificatie (COGEM ), Gezondheidsraad, 2017. Ingrijpen in het DNA van de mens, Morele en maatschappelijke implicaties van kiembaanmodificatie. COGEM; Bilthoven. |
|
COGEM nieuwsbericht (28 maart 2017). Ingrijpen in het DNA van de mens: doen of laten? |
|
MHRA (17 March 2017). Annual Review of MHRA GCP Referrals: 2016. |
|
International Federation of Pharmaceutical Manufactures & Associations (17 April 2017). Progress report on biopharmaceutical industry contributions to the global fight against Neglected Tropical Diseases (NTDs). |
|
Tao, Lili et al. (1 February 2017). Making Mouse Models That Reflect Human Immune Responses. Trends in Immunology , Volume 38 , Issue 3 , 181 - 193 |
Copyright © Vincent Bontrop, All rights reserved.
Contactgegevens:
Hopakker - 3514 BZ Utrecht - Netherlands
 |
 |